○発表のポイント:
◆がんが進行した患者の血中で見られるがん細胞の塊(CTCクラスター)は、高い転移発生率との関連性が示唆されていましたが、その発生過程はまだよくわかっていませんでした。
◆がん細胞の集団を配置した手のひらサイズの血管チップ(がん-微小血管チップ)を用いて、これらの細胞を生きたまま経時的に顕微鏡観察することで、がん細胞が血管に浸潤しCTCクラスターを形成するまでの一連のプロセスを可視化しました。
◆本研究で構築したチップは、血管内浸潤およびCTCクラスターの形成を標的としたがん転移を抑える治療開発に活用できる可能性があります。

開発したがん-微小血管チップ。血管構造の周囲にがん細胞集団を配置し、がん転移初期過程である、がん細胞集団の血管内侵入とがん細胞クラスターの放出過程の可視化を実現。
○概要:
東京大学 生産技術研究所の池田 行徳 大学院生(研究当時)、近藤 誠 助教、松永 行子 教授らのグループは、がん細胞クラスター(circulating tumor cell clusters:CTCクラスター)(注1)が血管内に形成する過程を可視化する「がん-微小血管チップ」を開発しました。腫瘍オルガノイドと血管内皮細胞を三次元培養し、がん細胞の集団移動、血管構造の乗っ取り(vessel co-option)、血管内へのクラスター放出という一連のプロセスを世界で初めて明確に観察しました。特に、がん細胞由来のTGF-β(トランスフォーミング増殖因子β)(注2)が内皮細胞にEndoMT(endothelial-mesenchymal transition:内皮-間葉転換)(注3)を誘導し、さらに内皮細胞が分泌するActivin(TGF-βファミリーのメンバー)(注4)ががんの浸潤性を高める「がん-血管相互作用による悪性化の連鎖」が、CTCクラスターの血管侵入と形成に重要であることを示しました。本成果は、がん転移抑制を目指すがん転移メカニズムの解明、治療標的分子の探索、および創薬スクリーニングに貢献する革新的なプラットフォームとなることが期待されます。
○発表者コメント:松永 行子 教授の「もしかする未来」
この研究を始めたきっかけは、私が専門とする生体外で生体組織構造や微小環境を再現・制御・解析する細胞工学技術を用いて、からだの中で起きている現象を細胞や組織レベルでとらえ、疾患現象の解明や、予防技術の開発へ貢献したいと思ったからです。今回、金沢大学・大島正伸教授のグループが、多様な遺伝的な背景をもつがん細胞の集まりが遠隔臓器に転移する様子を動物実験でとらえたことを受け、「がん細胞集団はどのように血管を介して遠隔臓器に転移するのか?」というがん転移のブラックボックスを明らかにするために複数の研究機関とチームを結成し研究を始めました。この成果は、がんの転移のしくみをより深く理解する手がかりとなり、患者ごとの転移リスクの評価や、新しい治療薬の開発につながる可能性があります。今後もさまざまな分野の専門家と協力しながら、未来の医療につながる技術を生み出していきたいと思います。
○発表内容:
本研究では、「がん細胞がどのように血管内へ侵入し、がん転移が引き起こされるのか?」というがん転移の初期過程におけるがん細胞集団と血管との相互作用を明らかにするため、三次元の血管構造周囲にがん細胞集団を配置した三次元in vitroモデル「がん-微小血管チップ(tumor-microvessel on-a-chip)」を開発しました。
がん転移の初期過程である「血管内侵入(intravasation)」は、がん細胞が血管内に入り込む重要な過程です。血中で検出されるがん細胞には、単一細胞として存在するものに加え、複数のがん細胞が集団を形成したCTCクラスターも報告されており、クラスター状のがん細胞 は転移能が高く、患者の予後不良と関連することが報告されています。がん転移に関する従来の実験手法では、動物体内にがん細胞を移植し、一定期間後に他臓器における転移巣の形成を評価する方法が主に用いられてきました。しかしこのアプローチでは、がん細胞集団が血管内へ侵入する過程や、血管内でCTCクラスターがどのように形成されるのかといった転移初期の細胞動態を詳細に観察・解析することは困難でした。
そこで本研究では、マイクロ流体デバイス技術を用いて、がん細胞集団と血管を三次元的に配置可能な培養デバイスを構築しました。特に、転移能の異なる腸管由来腫瘍オルガノイド(非転移性:AP細胞、転移性:AKTP細胞)(注5)を用い、がんと血管との距離を制御した「近接配置モデル」と「遠隔配置モデル」を作製しました。これらのモデルを用いて観察を行った結果、転移性の高いAKTPオルガノイドでは、血管に対して、接触、侵入し、血管内壁に沿って移動し、その構造を取り込んで共用する「vessel co-option(血管の乗っ取り)」を起こした後、腫瘍クラスターが血管内に放出される現象が確認されました。一方で、APオルガノイドではそのようなクラスター放出は稀であり、転移性と非転移性のがん細胞集団間で明確な浸潤パターンの差異が見られました(図1)。
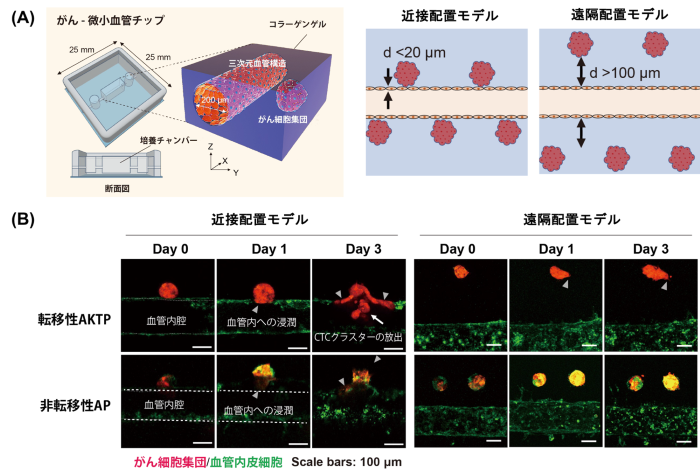
図1:がん-微小血管モデルにおけるがん細胞集団と血管相互作用解析。
(A)がん-微小血管チップの概要図。(B)がん細胞集団と血管の共焦点レーザー顕微鏡観察。転移性AKTP細胞集団は、近接配置モデルにおいて、血管を乗っ取り、CTCクラスターを放出する様子が観察された。遠隔配置モデルでは、浸潤突起形成が確認された。
さらに分子メカニズムを解析したところ、AKTP細胞が分泌するTGF-βが、血管内皮細胞のEndoMTを誘導することで、血管内皮細胞の接着性が低下し、血管構造が崩れることが判明しました。この血管内皮細胞の変化により、血管バリアが破綻し、がん細胞クラスターが侵入しやすくなると考えられます。加えて、遺伝子発現解析から、血管内皮細胞側ではTGF-βおよびActivinの遺伝子発現が誘導され、それらが腫瘍細胞側の浸潤突起形成をさらに促進する、双方向的な「悪性連鎖」が形成されることも明らかとなりました。加えて、このTGF-β/Activinシグナルを阻害するTGF-β 阻害剤やフォリスタチン(Activin阻害分子)を用いた検証実験では、いずれも腫瘍の浸潤性や血管内皮側のEndoMTが有意に抑制されることを確認しました(図2, 3)。特にTGF-βの阻害はEndoMTの抑制に有効であり、Activinの阻害はがん細胞の浸潤突起形成を抑制するなど、個別の役割の違いも示されています。
本研究成果は、がん転移における血管内浸潤とCTCクラスター形成という転移初期の現象を、空間的に制御されたチップ上で可視化・定量化することに成功した点で、がん転移メカニズムの理解に新たな知見を提供する重要な成果です。将来的には、CTCクラスターの形成を防ぐ分子標的薬の開発や、転移抑制に向けた薬剤スクリーニングへの応用が期待されます。また、本in vitroシステムは、がん研究にとどまらず、血管機能異常の解析や免疫細胞の浸潤動態の評価など、多様な細胞間相互作用研究への展開も期待されます。
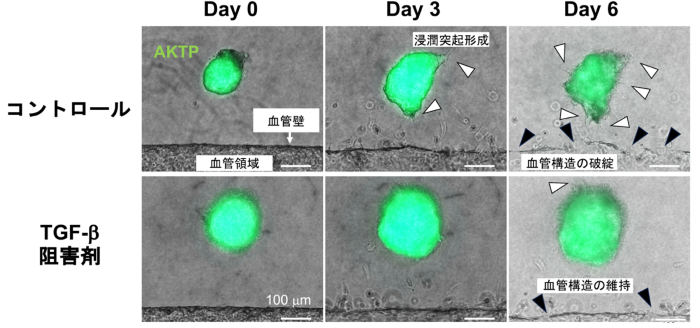
図2:がん-微小血管モデルにおけるTGF-β阻害実験。
TGF-β阻害剤処理により転移性AKTP細胞集団における浸潤突起形成の抑制と血管構造の維持が確認された。
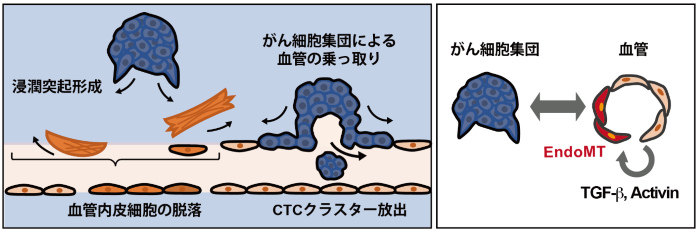
図3:本研究成果の模式図。
(左)転移性がん細胞集団(AKTP細胞)はEndoMTを誘導し、血管を乗っ取りCTCクラスターを放出する。(右)がん細胞集団が血管内皮細胞に作用し、血管内皮細胞側のTGF-βおよびActivinの発現上昇による、がん-血管相互作用による悪性化の連鎖が進行する。
○発表者・研究者等情報:
東京大学
生産技術研究所
池田 行徳 博士課程(研究当時)
近藤 誠 助教
ポティ ジョリス 特任研究員(研究当時)
松永 行子 教授
金沢大学
がん進展制御研究所
大島 浩子 准教授
ワン ドン 助教
コク サウ JSPS外国人特別研究員(研究当時)
大島 正伸 教授
東京科学大学
大学院医歯学総合研究科
高橋 和樹 助教
渡部 徹郎 教授
杏林大学
医学部
末弘 淳一 助教
櫻井 裕之 教授
○論文情報:
〈雑誌名〉iScience
〈題名〉A tumor-microvessel on-a-chip reveals a mechanism for cancer cell cluster intravasation
〈著者名〉Yukinori Ikeda✝, Makoto Kondo✝, Jun-ichi Suehiro, Hiroko Oshima, Sau Yee Kok, Kazuki Takahashi, Joris Pauty, Dong Wang, Hiroyuki Sakurai, Tetsuro Watabe, Masanobu Oshima*, Yukiko T Matsunaga* (*共同責任著者、✝共同筆頭著者)
〈DOI〉10.1016/j.isci.2025.112517
○研究助成:
本研究は、「国立研究開発法人 日本医療研究開発機構 次世代がん医療創生研究事業」(AMED P-CREATE)(JP21cm0106272, JP22ama221205)、「金沢大学がん研究所・学外共同研究助成金」、「JSPS特別研究員奨励費 (JP23KJ0490)」、「公益財団法人 日本科学協会 笹川科学研究助成」、「WINGS-QSTEP」などの支援により実施されました。
○用語解説:
(注1)CTCクラスター
CTCは血中を循環する単独の腫瘍細胞、CTCクラスターはこれらの細胞が集団化した細胞塊。
(注2)TGF-β(トランスフォーミング増殖因子β)
細胞間の情報伝達を担うサイトカインの一種。細胞の増殖・分化・細胞死・免疫応答・組織修復などを制御し、がん浸潤・転移に関与することが知られる。
(注3)EndoMT(endothelial-mesenchymal transition:内皮-間葉転換)
内皮細胞が間葉系様細胞に分化転換すること。
(注4)Activin
細胞の増殖や分化を調節するTGF-βファミリーのサイトカイン。
(注5)AP細胞・AKTP細胞
大腸がん発生と悪性化に重要な4種類のドライバー遺伝子(Apc(A)、Kras(K)、Tgfbr2(T)、Trp53(P))の変異を、組み合わせて導入した、腸管腫瘍由来オルガノイド。4種類の変異を持つAKTP細胞は高転移性のがん細胞で、2種類の変異をもつAP細胞は非転移性のがん細胞。
○問い合わせ先:
東京大学 生産技術研究所
教授 松永 行子(まつなが ゆきこ)
Tel:03-5452-6382
E-mail:mat-info(末尾に"@iis.u-tokyo.ac.jp"をつけてください)
