○発表のポイント:
◆イオンと水の相互作用は、自然科学、工学分野において極めて重要であるにもかかわらず、イオンが水溶液中で水の構造やダイナミクスに与える影響が、イオン種に強く依存する物理的なメカニズムは未解明であった。
◆イオンの大きさと電荷量を連続的に変えるという新たな方法により、イオンと水分子との相互作用を系統的に制御することで、イオン周りの水分子の双極子配向、水和殻の形成、方位秩序形成という階層的な秩序化という全く新たな観点から、イオン種に依存した水への影響の特異性の物理的起源を明らかにした。
◆これらの発見は、水溶液中のイオンが関与する様々なプロセス、生命現象などに基礎的な知識を提供するとともに、イオン水溶液の制御と応用のための物理的な原理を提供するものと期待される。
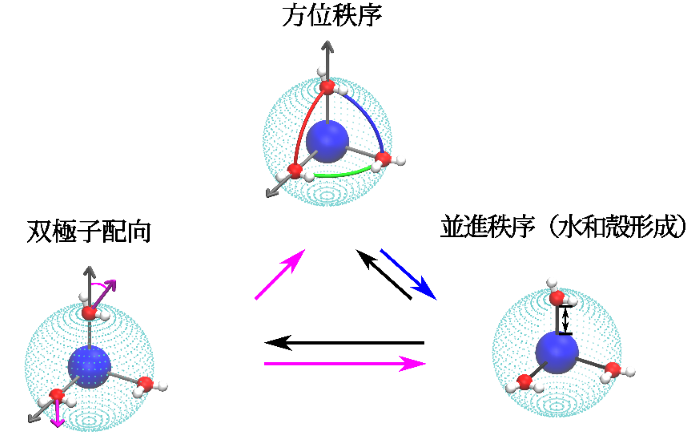
イオンの周りに形成される3種類の水の秩序の模式図
○発表概要:
東京大学 先端科学技術研究センターの田中 肇 シニアプログラムアドバイザー(特任研究員/東京大学名誉教授、研究開始当時:東京大学生産技術研究所 教授)、浙江大学 シー ルイ准教授(研究開始当時:生産技術研究所 特任研究員)、カリファルニア大学 サンタバーバラ校 博士課程学生 クーパー アンソニー(研究開始当時:生産技術研究所 協力研究員)の共同研究グループは、現実に存在するイオンごとに水に与える影響を研究するという従来の方法ではなく、仮想的なイオンの電荷と大きさを連続的に変化させることで、水とイオンの相互作用のイオン種に依存した特異性を物理的に解明することに成功しました。
イオンは、水に溶けたときにイオン特有の複雑な挙動を示しますが、自然界や科学技術分野においてイオンの溶媒和が基本的に重要であるにもかかわらず、その特異性の起源は、いまだに解明されていません。
研究グループは、このようなイオン特有の性質を、イオン-水間の静電相互作用(注1)と水分子間の水素結合の競合による、イオン周りの水の構造の階層的な双極子(注2)配向、水和殻(注3)形成、方位秩序(注4)形成によって説明しました(図1参照)。同グループはまず、この競合を新しい長さλHB(q) (q:イオンの電荷)によって特徴づけ、溶液ダイナミクスに対するイオン特有の効果を説明しました。この新たに導入された長さは、イオン水溶液中の構造的、動的、エネルギー的なクロスオーバーを統一的に記述することが可能です。これまで、電解質水溶液を理解するために、水の連続媒体として記述をもとに、デバイ長(注5)、ビエルム長(注6)といった基本的な長さが導入されました。しかしながら、イオンが与える水への影響を理解するには、水の微視的な記述に基づき、水特有の水素結合能を考慮したλHBを導入することが、不可欠であることが明らかになりました。
また、研究グループは、イオンサイズと電荷を連続的に調整することで、イオン水和殻内の水分子の方位秩序が特定のイオンサイズと電荷の組み合わせで大きく発展することを見出しました(図2参照)。また、この方位秩序形成の問題が、古典的な原子の周りの電子の配置に関するトムソン問題(注7)と深い関係があることも明らかになりました。この方位秩序化は、水和殻を劇的に安定化させ、その程度によってイオン周りの水の滞留時間は主なイオンで11桁も変化することを見出しました(図2参照)。
これらの発見は、水溶液中のイオンプロセスの基礎となるもので、生命現象の理解や電解液の設計や応用に必要な物理原理を提供するものと期待されます。
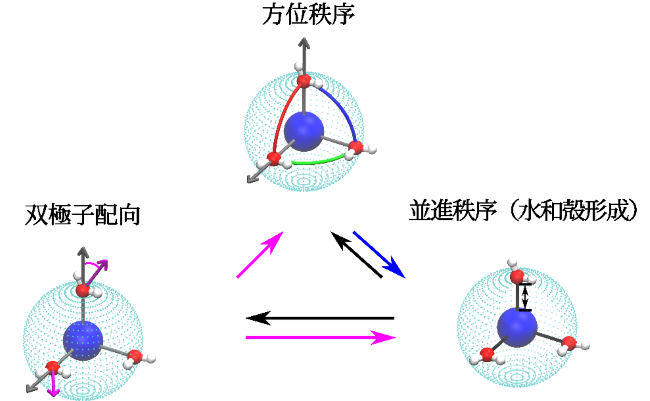
図1:イオンの周りに形成される3種類の水の秩序の模式図
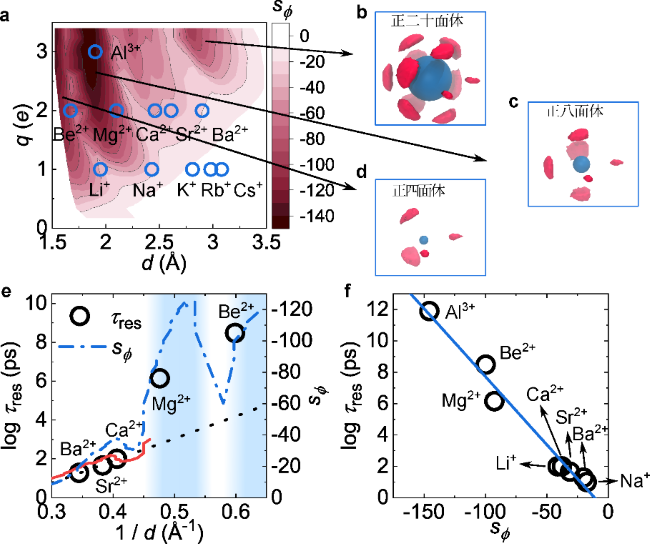
図2:イオン周りの水の方位秩序形成に伴う水和殻の安定化。
a)水和殻の配向エントロピーの電荷q、イオンからの水和殻までの距離d依存性。b)正二十面体配位。c)正八面体配位。d)正四面体配位。e)水和殻の水分子の滞在時間、配位エントロピーと1/dの関係。f)様々なイオンの周りの水和殻の水分子の滞在時間と配位エントロピーの関係。
本成果は2023年8月7日(英国夏時間)に「Nature Communications」のオンライン速報版で公開されました。
○発表内容:
イオンの溶媒和は、溶液中のイオンダイナミクスの観点から、理論的に盛んに議論されてきました。イオンと双極子の相互作用を流体力学に取り入れた理論により、イオンは、溶液中で流体力学的な摩擦の他に誘電的な摩擦を経験することが示されました。この画期的な考え方は、イオン性溶液に対して成功裏に確立され、イオンのダイナミックスのイオンサイズと電荷依存性を定性的に説明しました。しかし、水の連続体記述に基づくこのモデルは、溶媒構造や溶媒-溶媒(水素結合)相互作用を無視している、溶媒のダイナミクスに対するイオン効果の特異性を記述する上で本質的な困難を抱えています。
塩が与える水溶液のダイナミクスへの影響が、Jones-Dole方程式
(ここで、ηは塩溶液の粘度;η0は水の粘度;cは塩濃度)で記述できることは、1929年から経験的に知られていました。 イオン-イオン相関に基づく理論が開発され、係数Aを短時間で計算することには成功しましたが、イオン-溶媒相互作用を考慮した係数Bの物理学的性質については議論が続いています。連続体理論と同様に、その困難さは、主にイオンによる水の構造変化に関する詳細な情報の欠如に起因していると考えられます。係数Bとイオンエントロピー(注8)の間に良好な反相関があることが実験で報告されたため、イオンを「秩序を生み出す」タイプ(B>0)と「秩序を破壊する」タイプ(B<0)への分類がポピュラーになりました。 この「秩序」は、水素結合がバルクでの水のダイナミクスを決定する最も重要な要素であるため、当然ながら水の水素結合の秩序とみなされてきました。しかし、最近の実験やシミュレーションはこの解釈を強く否定し、イオン水溶液の熱力学的、構造的、動的測定との間に矛盾を残していました。
研究グループは、この問題に取り組むにあたって、従来の現実に存在するイオンについて網羅的に研究する方法では、物理的本質に迫ることは困難であると考え、元来離散的なイオンの大きさと電荷を連続的に変化させるという全く新たなアプローチを採用しました。その結果、イオンが誘起する水の構造秩序化は、多重的かつ階層的であることを発見しました。イオン電界強度の増加に伴い、水の双極子は、イオンに対して放射状に並ぶようになります。水双極子の放射状配置は、水が好む四面体方向の水素結合と相反するため、双極子秩序の発達は必然的に水-水間の水素結合を乱し、水和殻の水素結合数と強度の減少をもたらすことが明らかになりました。
同時に、イオン場は、水をイオンの近くに引き寄せ、並進秩序を発達させ、イオンの周りに殻構造を形成します。弱電荷イオンでは、ファン・デル・ワールス相互作用が支配的で、水分子はイオンの周りに厚い水和殻を形成しますが、その中では水素結合が依然として保たれる傾向があります。電荷qが臨界値以上になると、イオンは、水の双極子を半径方向に整列させながら水分子と強く結合するようになります。このようなイオン周囲の水分子の協調的な構造変化により、第1殻と第2殻の間に形成される架橋水素結合が切断され、比較的並進秩序の高い薄い水和殻が形成されます。この特殊な殻構造を「イオン性水和殻」と呼び、水溶液中の現実的なほとんどの金属イオンの周りに実際に形成されることが明らかになりました。
イオンは、水分子をその周りの薄い球状の殻に閉じ込め(並進秩序)、双極子の向きを半径方向に揃えます(双極子秩序)。水和殻の水分子の数が素数でない複合数の場合、薄い球状の殻に閉じ込められた水分子間の反発的な双極子相互作用により、特定の多面体対称性を持つ方位秩序が自己組織化敵に形成されます。これは、トムソン問題として知られる古典的原子における電子の配置に類似した現象として理解できます。結合配向秩序の出現は、水の並進秩序をさらに強化し、水和殻を劇的に安定化します。その程度は、イオン溶媒和のダイナミクスを本質的に決定することになります。ただし、このメカニズムは、水和水の結合配向対称性がイオンのd軌道とf軌道の方向に従う遷移金属イオンやランタニド基イオンには適用できない可能性があることに注意する必要があります。
これまでイオン溶液は、デバイ長λDとビエルム長λBの2つの基本長で特徴づけられてきましたが、それらはイオン-イオン相互作用のみに着目したものでした。しかし、水分子は、電気双極子を持つため、イオン-水相互作用と水-水間の水素結合との競合を考慮することが不可欠です。 実際、上述のように、イオン-水相互作用と水-水間の水素結合相互作用の競合により、溶媒和時に3種類の構造秩序―双極子配向、並進秩序、結合配向秩序―が生じることが明らかになりました。そこで、イオン水溶液中のイオン-水、水-水間の相互作用を評価するために、新しい長さλHBを導入することが重要となります。この長さλHB は、イオン-水相互作用と水-水間の水素結合の間の競合を特徴付け、これによりイオンが水のダイナミクスに与える影響を自然に説明することができます。つまり、イオン-水相互作用が支配的な領域と水-水結合が支配的な領域をq-d平面上で分離する境界を提供します。前者の領域(d<λHB )では、イオンは溶液中に双極子秩序、並進秩序、結合配向秩序を生成し(いわゆる「秩序生成」)、水のダイナミクスを加速します(B>0)。一方、後者(d>λHB )では、イオンは水の四面体秩序を破壊し(いわゆる「秩序破壊」)、水のダイナミクスを加速する(B<0)。このように、水の水素結合を考慮した新しい長さλHBの導入により、イオン水溶液の熱力学的、構造的、動的挙動を統一的に説明することが可能となり、イオン分類の矛盾を解決することができます。基本的な長さスケールλHBと階層的な構造秩序は、溶液中のイオン特有の溶媒和効果に新しい物理的洞察を与え、物理、化学、生物、材料、技術応用におけるイオンプロセスの理解に大きな影響を与えることが期待されます。
このような研究により、イオン溶液の挙動を統一的に説明し、イオン分類の矛盾を解決する可能性が広がりました。これにより、イオン溶液の理解が深まり、エネルギー変換、電池、触媒などの重要な応用分野において、より効率的かつ持続可能な技術の開発が促進されることが期待されています。さらなる研究が進められることで、イオン溶液の複雑なダイナミクスについての理解が深まり、様々な科学分野における革新的な進展が生まれると期待されます。
○発表者:
東京大学
先端科学技術研究センター
田中 肇 (シニアプログラムアドバイザー(特任研究員)/東京大学 名誉教授)
〈研究開始当時:東京大学 生産技術研究所(教授)〉
生産技術研究所
シー ルイ (研究当時:特任研究員、現:浙江大学 准教授)
クーパー アンソニー(研究当時:研究実習生/米国ラトガース大学 学部生、
現:カリフォルニア大学サンタバーバラ校博士課程学生)
○論文情報:
〈雑誌〉Nature Communications(8月7日)
〈題名〉Impact of hierarchical water dipole orderings on the dynamics of aqueous salt solutions
〈著者〉Rui Shi*, Anthony Cooper,* and Hajime Tanaka*
*責任著者
〈DOI〉 10.1038/s41467-023-40278-x
○研究助成:
本研究は、文部省科学研究費 特別推進研究(JP20H05619、JP25000002) ならびに基盤研究(A)) (JP18H03675)、三菱財団研究助成の支援により実施されました。
○用語解説:
(注1)静電相互作用
異なる電荷を持つ物質同士が引かれたり、反発されたりする力。
(注2)双極子
一対の正負の同じ大きさの単極子がわずかに離れた位置にある状態。
(注3)水和殻
イオンが溶液中に存在する際に周りの水分子によって形成される特殊な構造。イオンは水分子を引き寄せ、周囲の水分子がイオンの周りに集まって特定の配置を取る。このような構造は、イオンの周りにできる水の「殻」のようなもので、イオンのダイナミクスに影響を与える重要な役割を果たす。
(注4)方位秩序
物質内部の分子や原子が特定の方向性を優先して取る現象。ここでは、イオンの周りの放射状の正多面体的な配置の秩序をさす。
(注5)デバイ長
溶媒中で多数のイオン(荷電粒子)が動いて電場を遮蔽する現象(デバイ遮蔽)において、その遮蔽が有効になる長さのスケールのことを言う。
(注6)ビエルム長
電解質溶液中でイオンの電荷の効果が熱エネルギー程度に減少する距離のことを指す。
(注7)トムソン問題
原子の中にある電子と正電荷の核が、どのように配置されるべきかという問題。
(注8)エントロピー
物理学や熱力学において、系の乱雑さや無秩序さの度合いを示す指標。一般的に、エントロピーは系の微視的な状態の数え上げに関係しており、状態の数が多いほどエントロピーが高く、状態の数が少ないほどエントロピーが低い。
○問い合わせ先:
東京大学名誉教授
東京大学 先端科学技術研究センター
シニアプログラムアドバイザー(特任研究員)
田中 肇(たなか はじめ)
Tel:03-5452-6125
E-mail:tanaka(末尾に"@iis.u-tokyo.ac.jp"をつけてください)
