○発表者:
杉山 博紀(東京大学大学院総合文化研究科広域科学専攻 博士課程2年生/日本学術振興会特別研究員(DC1))
大崎 寿久(東京大学生産技術研究所 特任助教/神奈川県立産業技術総合研究所 人工細胞膜システムグループ サブリーダー)
竹内 昌治(東京大学大学院情報理工学系研究科知能機械情報学専攻/東京大学生産技術研究所 教授/神奈川県立産業技術総合研究所 人工細胞膜システムグループ グループリーダー)
豊田 太郎(東京大学大学院総合文化研究科広域科学専攻/生物普遍性連携研究機構 准教授)
○発表のポイント:
◆原始細胞を模した人工のモデル細胞を数十個同時にデバイス上に捕捉し、溶液を流し入れ、モデル細胞の挙動を顕微鏡観察する自動実験装置を開発した。
◆特定の蛍光分子を含む水溶液を流し入れると、流し入れている間でのみ、モデル細胞がこれらの分子を内部に溜め込むことを見出した。モデル細胞が流れによってデバイスに押しつけられると、モデル細胞の表と裏で分子組成が変化し、内部に浸み込んだ分子が外に漏れにくくなったためと考えられる。
◆生命起源の謎に迫る新現象の発見である。さらに、合成生物学の要素技術や分子ロボティクスの技術開発、新しい細胞治療法の開発への貢献も期待できる。
○発表概要:
原始細胞を模した人工のモデル細胞を数十個同時捕捉し、任意のタイミングで化学的・物理的刺激を加えながら個々のモデル細胞を顕微鏡観察できる双方向型自動実験装置「MANSIONs」(注1)を開発しました。モデル細胞は、細胞膜の主な構成要素であるリン脂質(注2)の二分子膜(注3)が袋状に閉じた10 µmほどの人工小胞体(注4)として作製しました。MANSIONsでモデル細胞を捕捉し、ウラニンという蛍光分子や蛍光標識されたアデノシン三リン酸(ATP、注5)の水溶液に曝したところ、水溶液を流し入れている間でのみ、これらの分子をモデル細胞内外の濃度差(注6)に逆らって内部に溜め込む現象が観測されました。この現象が生じる機構として、モデル細胞が捕捉されたまま流れに押しつけられると二分子膜の表と裏の分子組成が変化し、モデル細胞内に浸み込んだ分子が外に漏れにくくなるという機構を提案しました。本現象は、生命起源研究(注7)で謎の一つとされている原始細胞内の分子濃縮(注8)を説明しうる新現象の発見にあたります。さらに、モデル細胞を用いた合成生物学(注9)の要素技術や分子ロボティクス(注10)分野の発展、細胞を治療する薬剤投与技術への活用など、広範な展開・応用が期待できます。
○発表内容:
生命が地球に誕生した頃、DNAのもとになる核酸などの生体分子がどのようにして原始細胞に溜め込まれたのかは謎のままとなっています。現在の細胞はいずれも、光や化学物質を利用して、内外の濃度差に逆らって分子を細胞内に溜め込む高性能なタンパク質を細胞膜に配置し、このような課題を克服していますが、このタンパク質は多種類の小さなタンパク質が組み合わさった複雑な構造になっており、原始細胞が始めからこのような(複雑な)機構のタンパク質をもっていたとは考えにくいと言えます。また、細胞膜は、リン脂質という、親水性部位と疎水性部位をあわせもった脂質が疎水性部位を向き合わせた二分子膜で構成されているため、一般に、水に溶ける分子やイオンは細胞膜やリン脂質の膜を透過しにくいことが知られています。
本研究では、原始細胞の有力なモデルである、リン脂質でできた、細胞と同じ大きさ(直径が約10 µm)でタンパク質を全く含まない人工のモデル細胞を使い、水に溶ける分子の水溶液を流しながらモデル細胞に曝し続ける実験を行いました。このとき、モデル細胞が流出しないように、ポリジメチルシロキサン(注11)という透明なゴムでできた捕捉空間が微小な溝の中に配置されたマイクロ流体デバイス(注12)にモデル細胞を数十個同時に捕捉しました。また、水溶液をデバイスに流し入れる条件や観察条件を最適化し精確に実験を繰り返すために、顕微鏡観察した画像を解析し、その解析結果に応じて、顕微鏡やポンプなどを自動で制御する装置とプログラムを独自に開発し、この統括的な双方向型自動実験プラットフォームをMANSIONsと名付けました(図1)。
MANSIONsによって、特定の酸性リン脂質(注13)を含むモデル細胞を捕捉し、水溶性の蛍光分子ウラニンや、蛍光標識されたアデノシン三リン酸(ATP)の水溶液を流し入れると、流し入れている間のみ、半数以上のモデル細胞で内部蛍光強度が周囲よりも数倍~数十倍増大することを見出しました(図2)。デバイス内の支柱にモデル細胞が一過的に衝突するだけでも、その度に蛍光強度が増大することが観察されました(図3)。一方、流れを止めると徐々に蛍光強度は減少しました。別の水溶性蛍光分子を用いた場合にはモデル細胞内部の蛍光強度は増大せず、周囲よりも小さいままでした。流し入れる条件などを変えた実験結果から、本現象は、モデル細胞がデバイス内部で流れによって表面に押しつけられている間、モデル細胞の二分子膜の表と裏の分子組成が変化して、膜に浸みこみやすい分子が一度モデル細胞内に入ると、外へ漏れにくくなるものと考えられます。
本研究で新たに見出したこの溜め込み現象は、モデル細胞の分子組成や細胞を曝す水溶性分子の種類を変えて試験範囲を広げることができます。また、本研究で使用したマイクロ流体デバイスの捕捉空間は、生命が最初に誕生したと考えられる環境(例えば海底の熱水噴出孔、注14)にある多孔質(注15)の岩石内部を模倣したものと見立てることもでき、本現象の発見は生命起源における原始細胞の分子濃縮を説明しうるものとして大きな意義があります。さらに、モデル細胞にDNAやタンパク質を取り込ませて人工細胞をつくる合成生物学や、センサーと演算回路と駆動機構をすべて分子で創り上げる分子ロボティクスという新興研究分野で本現象は活用できます。また、細胞治療の医療分野におけるバイオリアクター(注16)の設計にも本研究成果は貢献しうると期待できます。
本研究成果は、東京大学、神奈川県立産業技術総合研究所の共同研究によるものであり、科学研究費補助金基盤研究(B)、文部科学省生命動態システム科学推進拠点事業複雑生命システム動態研究教育拠点からの支援を受けました。
○発表雑誌:
雑誌名:Communications Chemistry(日本時間2020年3月9日公開)
論文タイトル:Hydrodynamic accumulation of small molecules and ions into cell-sized liposomes against a concentration gradient
著者:Hironori Sugiyama, Toshihisa Osaki, Shoji Takeuchi*, Taro Toyota*
DOI番号: 10.1038/s42004-020-0277-2
○問い合わせ先:
東京大学大学院総合文化研究科広域科学専攻
准教授 豊田 太郎 (とよた たろう)
〒153-8902 東京都目黒区駒場3-8-1
TEL: 03-5465-7634(研究室直通)
URL: https://park.itc.u-tokyo.ac.jp/toyota_lab/
○用語解説:
(注1)双方向型自動実験装置「MANSIONs」:濃度・エネルギーや力が釣り合いの状態から離れている環境におかれた分子集合体の計算機支援型多数同時双方向観測法(Machine-Assisted, Numerous, Simultaneous, and Interactive Observation of Non-equilibrium self-assembly)の略称。
(注2)リン脂質: リン酸を含む脂質。細胞膜の主要な成分である。
(注3)二分子膜: 水になじみやすい部位(親水性部位)と水になじみにくい部位(疎水性部位)をあわせもつ分子が、水になじみにくい部位を向かい合わせてシート状に会合した膜。リン脂質の二分子膜は細胞膜の基本構造である。
(注4)人工小胞体: 一枚の二分子膜が閉じて袋になった構造体。
(注5)アデノシン三リン酸(ATP):生物が共通して代謝で繰り返し用いる分子の一つであり、DNAの一部と部分構造を共有する分子でもある。
(注6)濃度差: 膜の内と外で水溶性分子の濃度が異なる状態。通常は、水溶性分子は濃度差がゼロになるように膜を移動するのみだが、本研究では、モデル細胞内部が低濃度で外部が高濃度だった状態から、流し入れた水溶性分子が膜を移動して濃度差が逆転し、内部が外部よりも高濃度になることがわかった。
(注7)生命起源研究: 地球上のどこで生命は誕生したのか、どういう物質で最初の生命は誕生したのか、を明らかにする研究。
(注8)分子濃縮: 生きている限り、内部で分子を代謝して生産し続けるため、生命体が環境から必要な分子を取り込み、環境よりも高濃度に保っている状態。
(注9)合成生物学: 現存の細胞を遺伝子工学や代謝工学で改変したり、ゼロから人工細胞を創ったりすることで、生命システムの成り立ちを調べたり、有用物質の生産へ応用する研究分野。
(注10)分子ロボティクス: 外部からの刺激に応答し、あらかじめプログラムされた化学反応で計算を行い、外部へ物質を放出したり変形したりする出力のできる、化学的に構築されたロボットを創出する研究分野。
(注11)ポリジメチルシロキサン: シリコーンの一種。微細な構造体の上に流し入れて、固化させて剥しとることが容易で、溝や微小構造体の型どりをして、ガラス基板などに張り付けることで微小空間をつくることができる。
(注12)マイクロ流体デバイス: マイクロメートルレベルの微小な空間や溝をつくり、そこへチューブを通じて液体や分散液を流し込んで、液体や分散液を反応させたり操作したりすることができる装置。
(注13)酸性リン脂質:リン脂質のうち、親水性部位がマイナスの電荷をもつ脂質。本研究ではフォスファチジルグリセロールを用いた。
(注14)熱水噴出孔: マグマ等で熱せられた地下水が海底から噴き出している海底の割れ目。煙突のような形状をしており、マイクロメートルサイズの微細な孔が無数にあいている。
(注15)多孔質: スポンジのように、微細な孔が無数につながってあいている物質の構造をさす。
(注16)バイオリアクター: 酵素や細胞・微生物を担持させて、反応溶液を流し込んで有用物質を生産させるための容器。細胞・微生物の培養や改変にも用いられる。
○添付資料: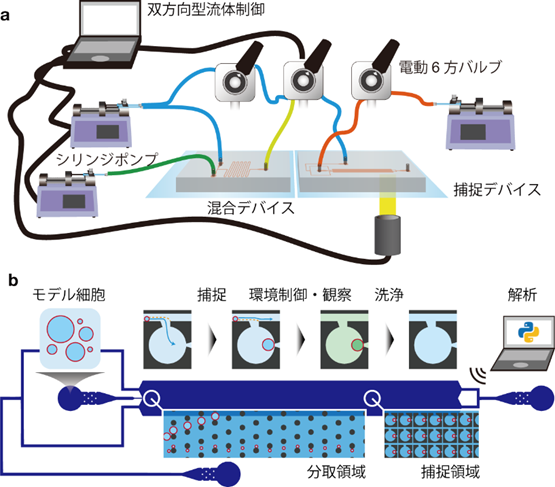
図1 開発した双方向型自動実験プラットフォーム「MANSIONs」。(a)システムの模式図。(b)モデル細胞を捕捉し観察するためのマイクロ流体デバイスの模式図。
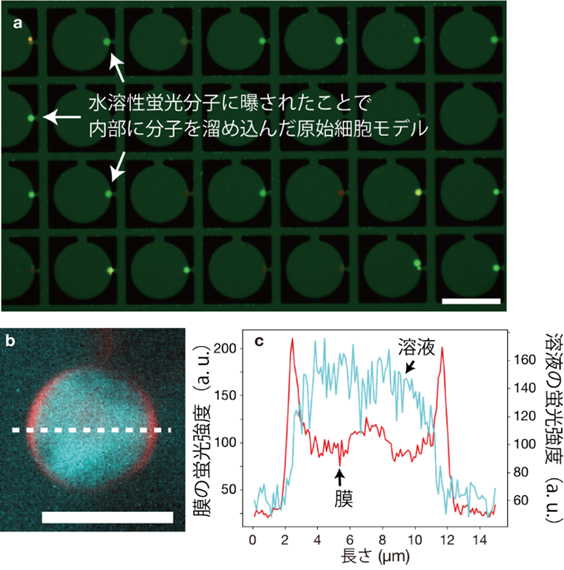
図2 内部に水溶性蛍光分子を溜め込んだモデル細胞。(a)15分間水溶性蛍光分子を流してモデル細胞に曝した後の蛍光顕微鏡写真。輝度が高いほど蛍光分子の濃度が高いことを示している。スケールバー:100 µm。(b)モデル細胞の膜と水溶性蛍光分子をそれぞれ疑似カラーで重ね合わせた蛍光顕微鏡写真。スケールバー:10µm。(c)図(b)内に示した白破線部における膜および溶液の蛍光強度を示したグラフ。
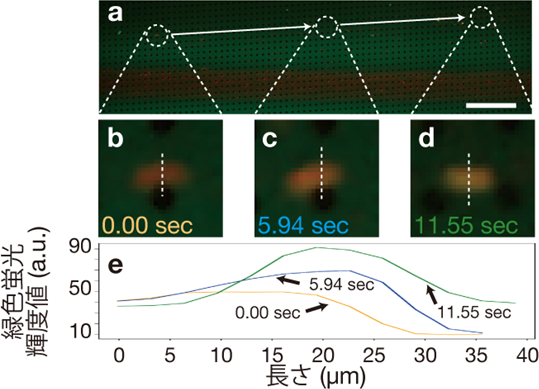
図3 (a-d)水溶性蛍光分子(緑)を含む水溶液中のモデル細胞が支柱構造(a-d中に規則的にみられる黒色の円群)に繰り返し衝突し、徐々に内部へ蛍光分子を溜め込む様子。(a)内において最左の白丸にいたモデル細胞(b)が5.94秒後(c)、11.55秒後(d)にいる位置をそれぞれ白丸で示し、その軌跡を白矢印で示した。徐々に蛍光分子が内部に溜まり、モデル細胞全体が明るくなっていく。(e)図(b-d)に示された白破線部における、緑色蛍光輝度値を示したグラフ。スケールバー:500 µm。
