○発表者
竹内 昌治(東京大学生産技術研究所 教授)
○発表のポイント
◆細胞ファイバ技術(注1)を用いて、内部にヒトiPS細胞(注2)を封入したアルギン酸ゲル(注3)の中空状マイクロファイバ(ヒトiPS細胞ファイバ)を作製し、培養することに成功した。
◆ヒトiPS細胞は本研究の培養法を用いることで、極めて効率よく増殖し(4日あたり平均約13~14倍)、その性質を長期に維持できることが明らかになった。
◆ヒトiPS細胞を用いた再生医療(注4)の基盤技術として、利用されることが期待される。
○発表概要
東京大学生産技術研究所の竹内昌治教授と池田和弘大学院生らの研究グループは、細胞ファイバ技術を用いて、ヒトiPS細胞を効率よく増殖させる技術の開発に成功しました。
ヒトiPS細胞を用いる基礎研究は比較的少量の細胞数で行われており、シャーレの底面に細胞を接着させる形で増殖させる二次元培養法が、簡便かつ安定的な培養法として用いられてきました。その一方で、大量の細胞数を要する再生医療への応用段階では、細胞を培地中に浮遊させる形で培養する三次元培養法が、コスト面において有用とされています。しかし従来三次元培養法では、ヒトiPS細胞が不均一なサイズで凝集塊を形成し、特に大きな凝集塊の内部では酸素や栄養の不足から細胞死が起こりやすく、全体として増殖率が低下したり、ヒトiPS細胞の性質が失われたりしやすいという問題がありました。
今回、竹内教授らは、細胞ファイバ技術を用いて作製された、ヒトiPS細胞を封入した中空状マイクロファイバ(ヒトiPS細胞ファイバ)を培養することにより、内部で形成される細胞凝集塊を、十分に細く均一な直径に維持し、細胞死を抑制することに成功しました。さらに、ヒトiPS細胞ファイバの内部に細胞外基質(注5)を加えることで、これまでにない高効率での増殖を実現しました。くわえて、この培養法は、内部の細胞が十分に増えた後、細胞を取り出し、新たにヒトiPS細胞ファイバを作製し培養再開するという継代作業を行うことができ、継代を繰り返すことで、長期に渡って高い増殖率(計算上約1ヶ月あたり10億倍の増殖)とヒトiPS細胞の性質が維持されることがわかりました。
本成果は、ヒトiPS細胞を用いた再生医療の基盤技術として利用できる可能性があり、再生医療の発展と普及に寄与することが期待されます。
○発表内容
【研究の背景と経緯】
ヒトiPS細胞は自分のコピーを無限に作製する「自己複製能」と、体の中のあらゆる細胞に分化(注6)できる「多分化能」を有しており、再生医療のための細胞の供給源として期待され、世界的に研究が進められています。ヒトiPS細胞の再生医療の実用化にむけて、現在重要な課題のひとつとしてあげられるのが、大量のヒトiPS細胞を確保するための培養法です。
再生医療にはしばしば大量の細胞の移植が必要になります(図1)。例えば、パーキンソン病治療のための神経細胞や、網膜変性症の治療のための網膜の細胞は、一人あたり105個程度の移植で十分ですが、糖尿病・心筋梗塞・肝不全への移植治療となると、必要な細胞数は約109~1010個にまで増えます。さらに、5Lの輸血に用いる赤血球を作製すると、一人あたり約2×1013個も必要です。ここに、ヒトiPS細胞から目的の細胞種へ誘導する効率も加味することになるため、実際に必要なヒトiPS細胞の数はこれ以上になると考えられます。
現在、ヒトiPS細胞を用いた基礎研究は、比較的少数の細胞で行われており、伝統的に二次元培養法という、シャーレの底面に細胞を付着させ増殖させる、安定的で簡便な培養法を用いています。しかし、シャーレ1枚あたりに得られる細胞数は約106~107個のため、この培養法をそのまま医療応用に用いると、一人の患者の治療のために、シャーレを数千~数万枚規模で扱わなければなくなり、それだけの培養を行うスペースや、管理を行う人件費が膨大になる上、細菌の混入リスクも増加するため、現実的ではありません。
そこで、医療応用のためのヒトiPS細胞の大量培養手段として、細胞を培地中に浮遊させながら増殖させる三次元培養法を用いたアプローチが取られています。三次元培養法の利点として、そのコストパフォーマンスの良さが挙げられます。例えば、二次元培養法のシャーレに小分けすると10万枚にもなる1トンの培地は、縦横高さ全て1mの立方体状タンクひとつに収容でき、非常にコンパクトになります。さらに、細胞を一括して扱えるため、品質管理や自動化にも向いており、人件費も大きく減らせます。
ただし、ヒトiPS細胞の三次元培養法には二次元培養法にはない欠点もあります。ヒトiPS細胞の三次元培養では、細胞を培地内に懸濁させ、その培地ごと撹拌しながら培養する手法(懸濁培養)が多く用いられています。このとき、ヒトiPS細胞は自発的に凝集塊を形成し増殖しますが、過剰な細胞の凝集や、凝集塊同士の凝集が起こりやすく、大きな凝集塊の内部に栄養や酸素が行き届かなくなり、細胞死や品質の低下、ひいては増殖率の低下などが起こることが問題でした。
そのため、大量培養法としてのヒトiPS細胞の三次元培養法は、いまだ定まりきっておらず、基礎研究から医療応用までには、数的質的ともに大きな隔たりが存在しています。基礎研究の発展にもかかわらず、それを医療応用までつなぐための培養法の未確立が、再生医療実現のためのボトルネックとなっているのが現状です。したがって、ヒトiPS細胞としての性質を保ったまま、効率よく増やすことのできる三次元培養法の開発は急務といえます。
【研究の内容】
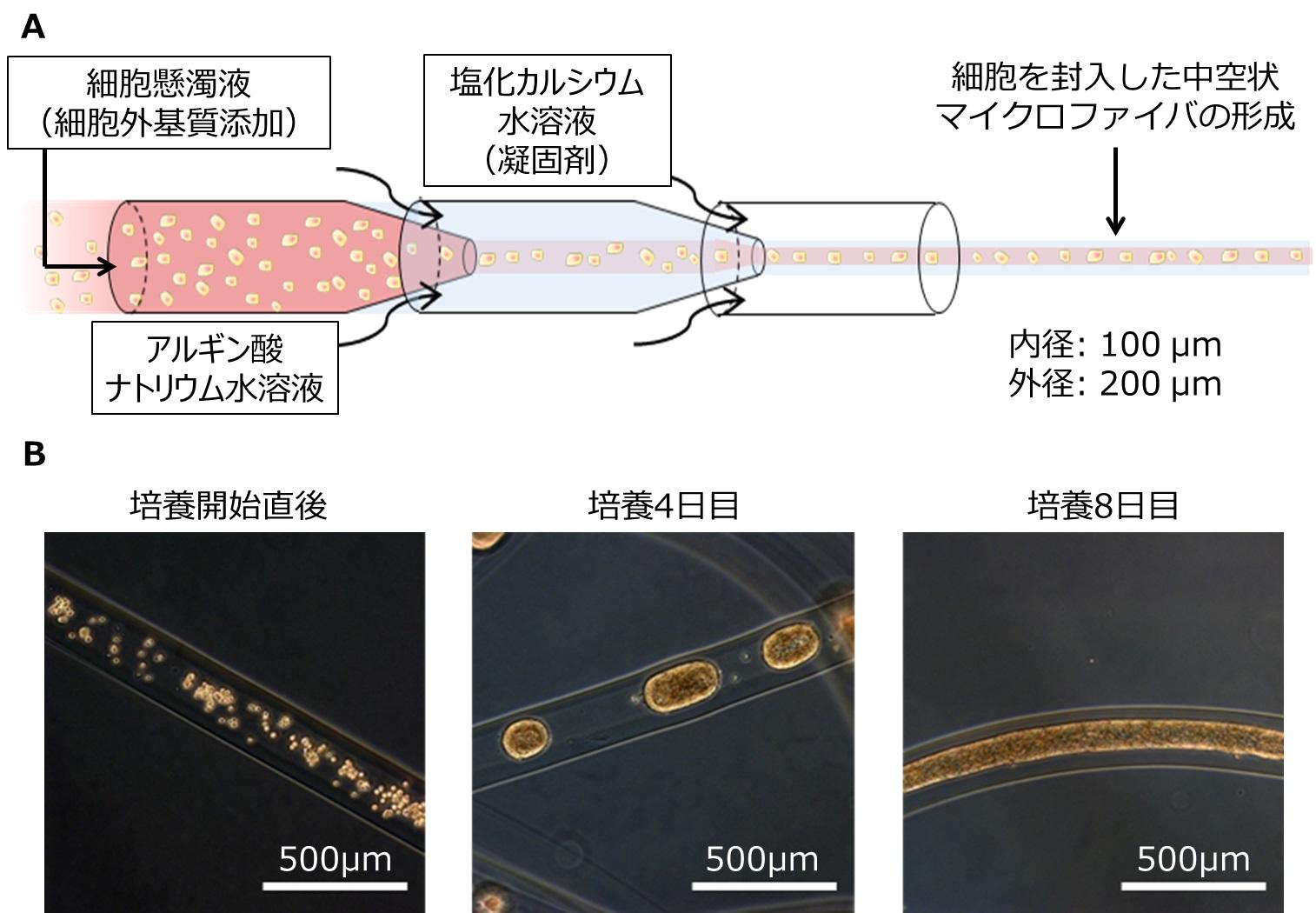
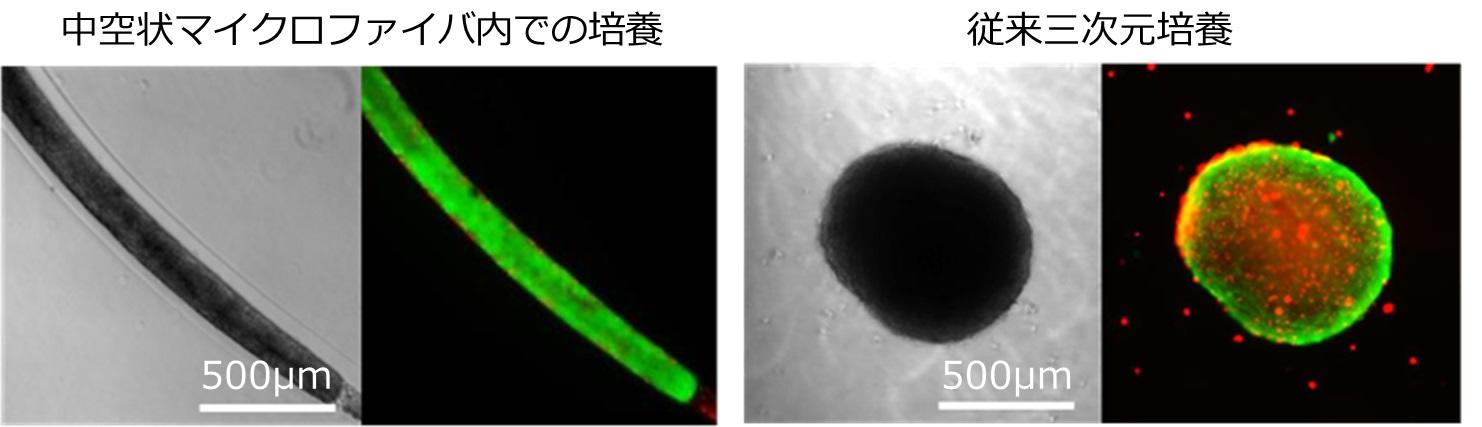
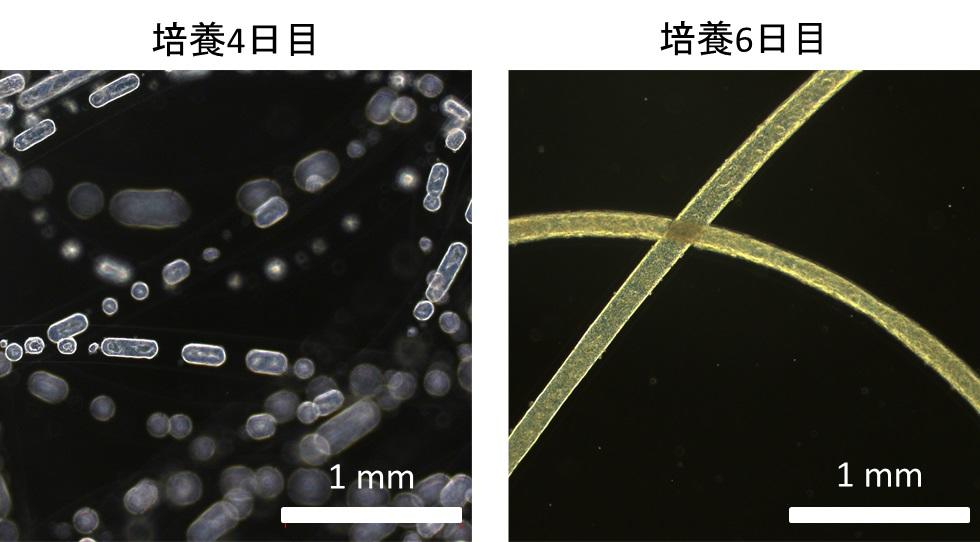
竹内教授らは、細胞ファイバ技術を応用し、マイクロ流体デバイス(注7)を用いて、ヒトiPS細胞をアルギン酸で構成された中空状マイクロファイバの内部に封入しました(図2A)。このヒトiPS細胞ファイバを培地中に浮遊させた状態で培養すると、内部のヒトiPS細胞が自発的に凝集し、凝集塊の厚みが制限された状態で、細長く内部を進展する形で増殖しました(図2B)。こうして形成されたひも状の凝集塊は、従来三次元培養で見られがちな、内部の細胞死が抑制されることがわかりました(図3)。これは、凝集塊の厚みが中空状マイクロファイバの内径に従い100μm程度と十分に小さく制限される上、凝集塊を被膜する外部のアルギン酸ゲルは物質をよく透過する性質があるので、内部まで酸素や栄養が行き渡ったためと考えられます。
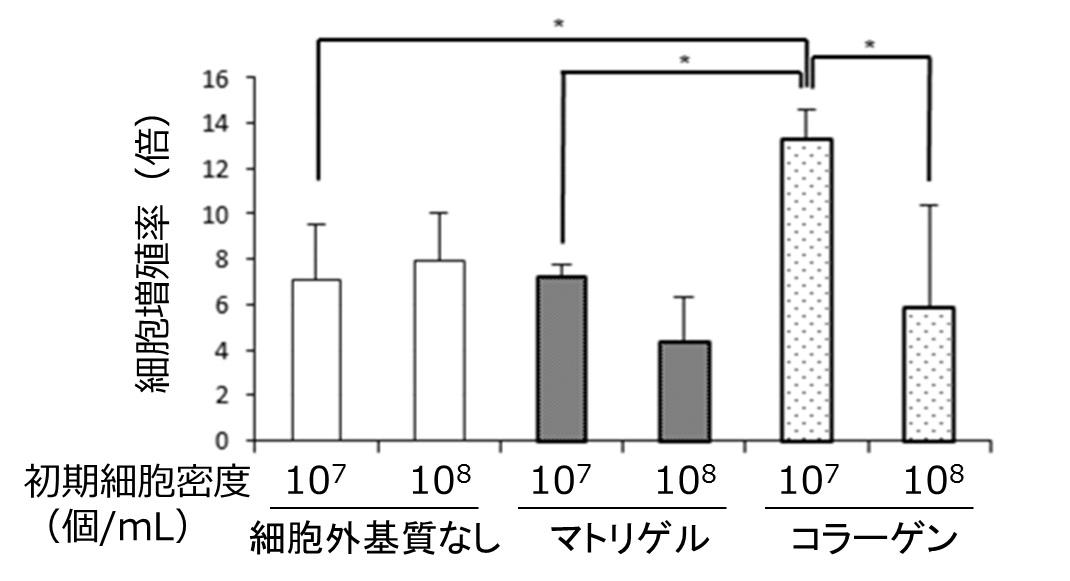
また、内部で効率よく細胞を増やすために、ヒトiPS細胞の増殖と性質維持に働く細胞基質をヒトiPS細胞とともに封入し、細胞密度を変えて条件検討したところ、細胞外基質としてコラーゲンを加え、比較的低密度に細胞を封入した場合、著しく高い細胞増殖率を示すことがわかりました(図4)。
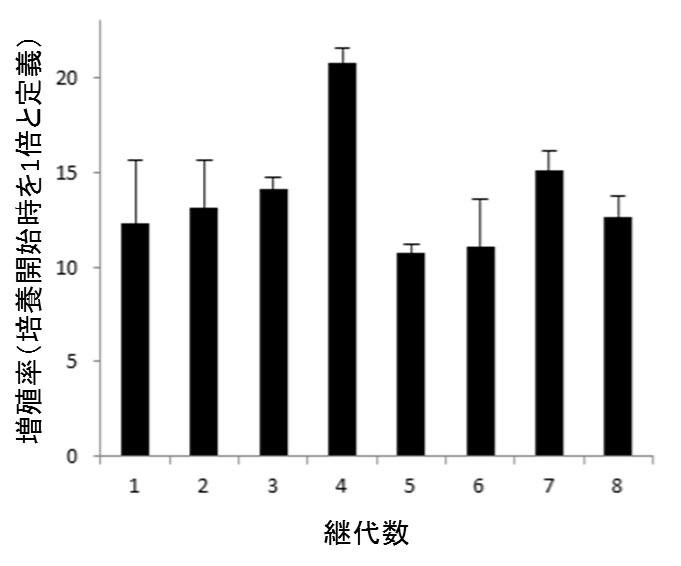
さらに、上記の条件を用いて培養した場合、そのままではいずれ内部空間に細胞が充満し、増殖が抑制されてしまいますが、ある程度細胞が増殖した時点で、内部の凝集塊を回収し、分散して所定の細胞密度に希釈後、再びヒトiPS細胞ファイバを作製し培養するという、継代作業を挟むことによって、効率のよい細胞増殖が長期的に維持されることがわかりました(図5)。各継代時の増殖率を累積することにより、理論上約1ヶ月で初期細胞数の10億倍に増殖させられたことになります。この増殖率をもとに計算すると、従来のヒトiPS細胞三次元培養法では、4日あたりの増殖率はせいぜい4~10倍程度なのに対し、本研究の平均増殖率は4日あたり約14倍であり、過去の報告と比較しても最も高い値を示しました。
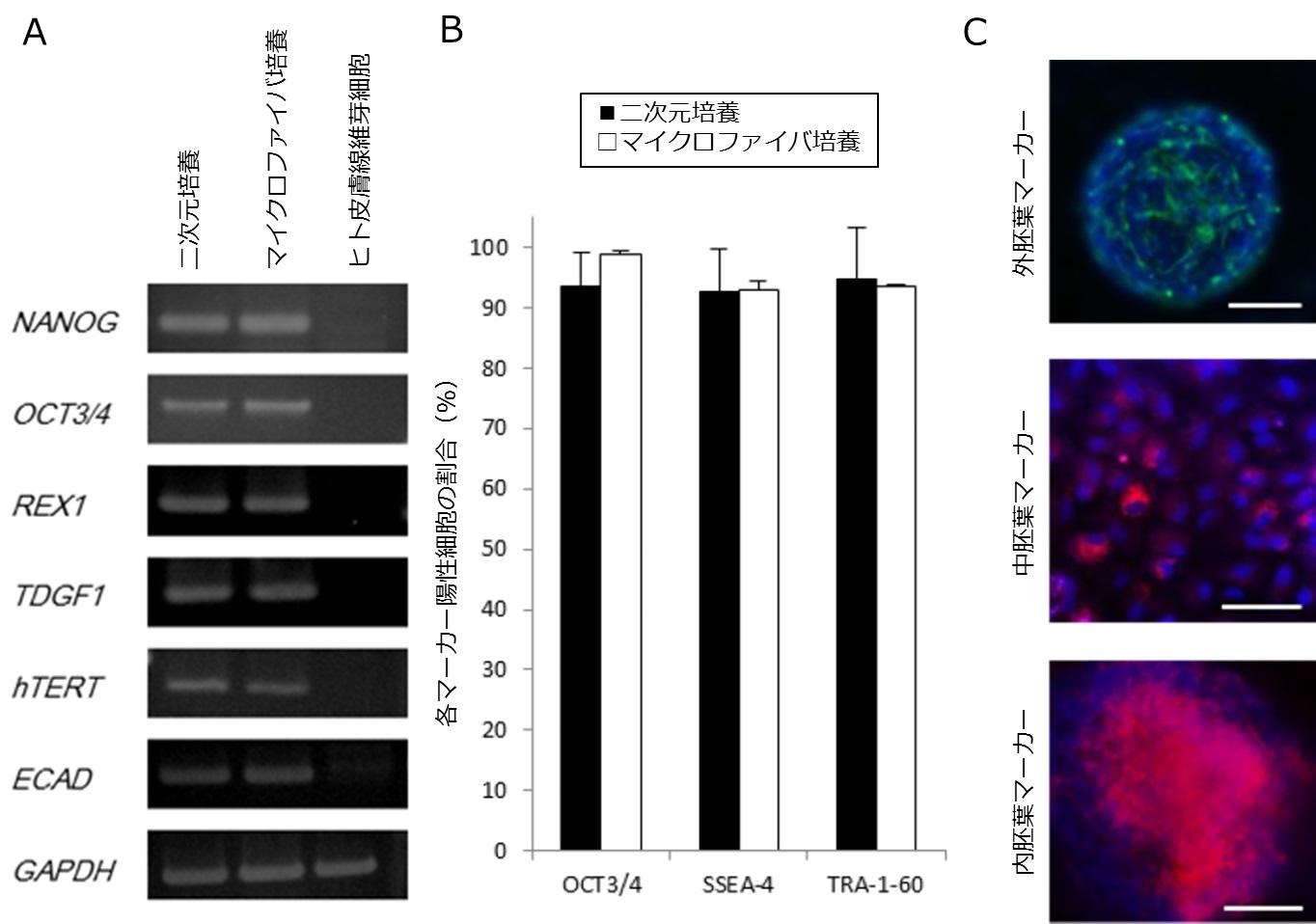
最後に、こうして得られたヒトiPS細胞が、本来もっていたヒトiPS細胞の性質、すなわち「自己複製能」と「多分化能」を維持しているか検証しました。自己複製能を調べるため、継代を重ねてヒトiPS細胞ファイバ内で長期培養した細胞を使用し、ヒトiPS細胞特異的な未分化マーカーの発現を調べたところ、既に安定して培養できるのが知られている二次元培養法で維持されたヒトiPS細胞と比較し、同等程度の発現を示すことがわかりました(図6AB)。くわえて、多分化能を調べるため、ヒトiPS細胞ファイバを分化誘導したところ、三胚葉(注8)の分化マーカー発現を示すことがわかりました(図6C)。
以上より、本研究の中空状マイクロファイバを用いた三次元培養法はヒトiPS細胞の細胞死の抑制と効率の良い増殖を実現し、かつその性質を長期的に維持できることが明らかになりました。
【今後の展開】
今回竹内教授らは、ヒトiPS細胞ファイバを作製し、効率よく細胞を増殖させる培養法の開発に成功しました。本成果は、量と質を担保しなければならない、再生医療応用のためのヒトiPS細胞培養法として応用されることが期待されます。今後は、この培養法を、どのような設備を用いて、実際の医療応用レベルの大量培養へと適用していくか検討していく予定です。
また、本成果はヒトiPS細胞のみならず、他の有用な細胞種の大量培養法として活用することも可能であると示唆されます。増殖による内部の細胞死を抑制しながら、細胞外基質とともに細胞培養できる場を提供できる有用性は、再生医療分野に限らず、さまざまな基礎研究においても貢献できるものと考えられます。
○発表雑誌
雑誌名:Scientific Reports
論文タイトル:Cell fiber-based three-dimensional culture system for highly efficient expansion of human induced pluripotent stem cells
著者: Kazuhiro Ikeda, Shogo Nagata, Teru Okitsu and Shoji Takeuchi
DOI番号:10.1038/s41598-017-03246-2
アブストラクトURL:http://www.nature.com/articles/s41598-017-03246-2
○問い合わせ先
東京大学生産技術研究所
教授 竹内 昌治(たけうち しょうじ)
Tel:03-5452-6650 Fax:03-5452-6649
研究室URL:http://www.hybrid.iis.u-tokyo.ac.jp/
資料
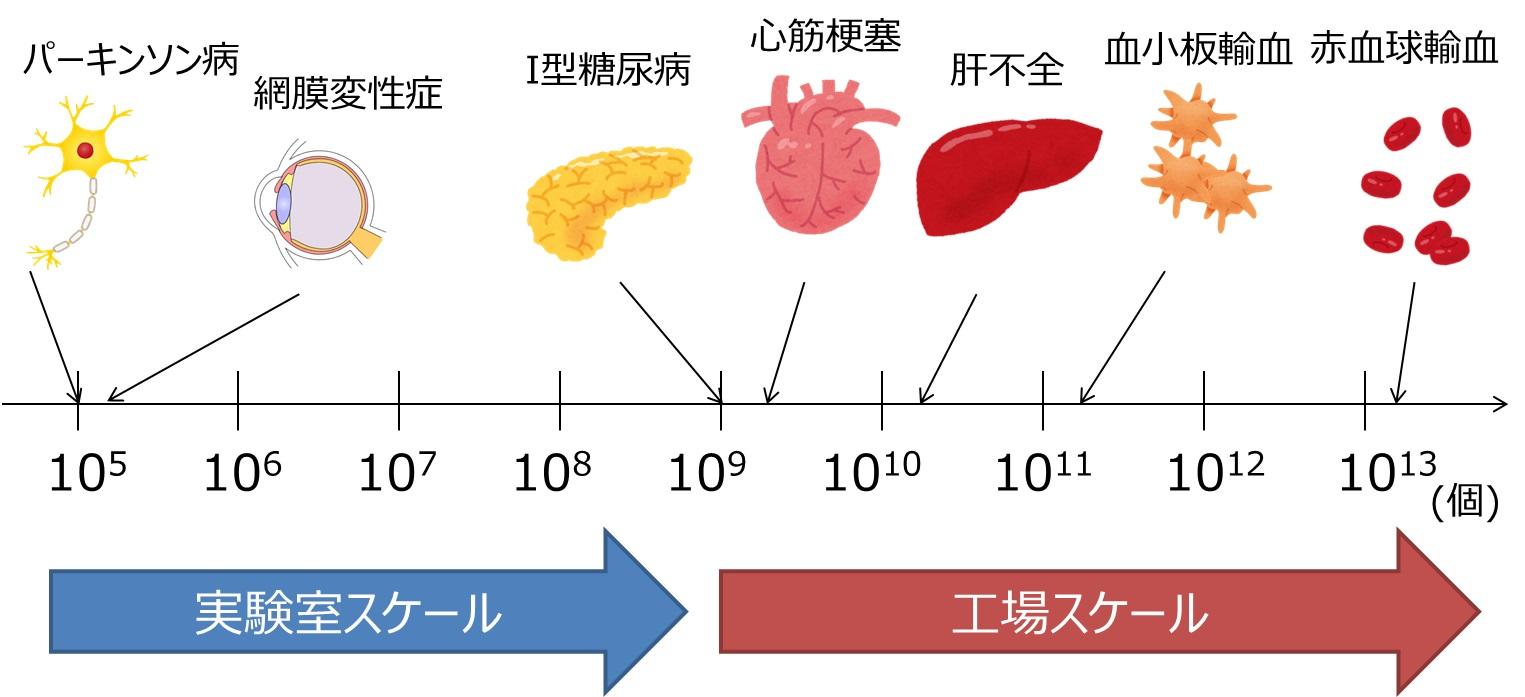
図1. 再生医療の対象となる病気と移植に必要な細胞数(一人あたり)
再生医療にあたり、その対象となる病気の部位によって、必要な移植細胞数は大きく異なります。大きな臓器や組織になるほど移植細胞数は増える傾向があり、体細胞の大きな割合を占める血球細胞は極めて大量に必要になると予想されます。ここに記載される細胞数は、移植される段階の分化後の細胞についてなので、そのもとになるiPS細胞はより多く必要になると考えられます。
図2. 中空状マイクロファイバへの細胞の封入とその培養
(A)細胞を封入した中空状マイクロファイバは、細胞懸濁液、マイクロファイバ外壁のもとになるアルギン酸ナトリウム水溶液、アルギン酸ナトリウムを固める塩化カルシウム水溶液をマイクロ流体デバイス内に流すことで作製されます。このデバイス内には微小な流路があり、内部の液体は流体が規則正しく並んだ層流という状態になるため、均一なマイクロファイバが形成されます。(B)マイクロファイバ内部の粒や塊が細胞とその凝集塊であり、外部の透明な部分がアルギン酸ゲルです。マイクロファイバ内に封入されたヒトiPS細胞は、はじめは疎に分散した状態ですが、培養することによって凝集塊を自発的に形成し、最終的には直径が制限されたまま、細長くひも状に伸びる形で増殖します。
図3. 従来三次元培養法と比較した培養後の細胞生存率
細長い形状の凝集塊を形成する中空状マイクロファイバ内での培養法と比べ(左図)、従来三次元培養法では球状の凝集塊を形成します(右図)。各培養法で8日間培養したヒトiPS細胞を、カルセインAM(生細胞を染色:緑色)とエチジウムホモダイマー(死細胞を染色:赤色)で染色すると、従来三次元培養法の凝集塊と比較し、ヒトiPS細胞ファイバ内では凝集塊内部での死細胞発生が抑制されていることがわかります。
図4. 細胞外基質と初期細胞密度の変化による細胞増殖率への影響
細胞外基質の種類と、初期細胞密度を変えたヒトiPS細胞ファイバを作成し、初期細胞数と比較した培養4日後の増殖率を計測しました。その結果、細胞外基質なし、マトリゲル(一般にヒトiPS細胞培養に用いられる細胞外基質)を含むものに比べ、比較的低細胞密度で封入したコラーゲンを含むものでの細胞増殖率が有意に高いことがわかりました。この増殖率は二次元培養法や過去の三次元培養法と比べても極めて高い値です。
図5. 継代によるヒトiPS細胞の長期培養
4日おきにヒトiPS細胞を継代し、8継代(32日間)培養しました。グラフは各継代時の増殖率です。平均の増殖率は約14倍であり、全ての増殖率を累計すると、計算上32日間で約10億倍に増殖させられたことになります。
図6. 中空状マイクロファイバ内で培養されたヒトiPS細胞の性状解析
(A)未分化なヒトiPS細胞特異的に発現する遺伝子(未分化マーカー遺伝子)について、二次元培養されたヒトiPS細胞、マイクロファイバ内で培養されたヒトiPS細胞、未分化マーカー遺伝子を発現しないヒト皮膚線維芽細胞を解析しました。マイクロファイバ内で培養されたヒトiPS細胞は二次元培養と同程度に未分化マーカー遺伝子を発現していることがわかります。(B)二次元培養されたヒトiPS細胞とマイクロファイバ内で培養されたヒトiPS細胞について、未分化マーカータンパク質を発現する細胞の割合を解析しました。二次元培養とほぼ同程度に未分化マーカータンパク質を均一に発現していることがわかります。(C)培養後の細胞を分化誘導し、各胚葉特異的な分化マーカータンパク質(緑もしくは赤)と核(青)を染色しました。マイクロファイバ内で培養されたヒトiPS細胞は三胚葉に分化する能力を保持していることがわかります(スケールバー:100μm)。
ヒトiPS細胞ファイバを培地中に浮遊させて培養すると、左図のように均一な厚みをもった細胞凝集塊が形成され、それが軸方向に伸長する形で増殖し、最終的には右図のようにヒモ状に繋がります。
用語解説
(注1)細胞ファイバ技術竹内昌治研究室で開発された、内部に細胞を封入した中空状マイクロファイバ(細胞ファイバ)を作製し、培養する技術。これにより、ヒモ状の三次元組織(例:神経、血管)を作製できることや、移植時の免疫拒絶反応から内部の細胞を保護できることが知られてきた。本研究では、細胞ファイバ内部の凝集塊のサイズが、マイクロファイバ内径に従って一定の厚みで維持されることに着目し、厚みや細胞の凝集を制御しつつ細胞を増やす三次元培養に応用した。
(注2)ヒトiPS細胞
山中教授らによって作製方法が確立された人工多能性幹細胞(induced Pluripotent Stem cell)のひとつであり、ヒトの体細胞に数種の遺伝子導入をすることで、無限の自己複製能と多分化能を獲得した細胞。例えばある人の毛根からiPS細胞を作製することで、その人自身のあらゆる組織を構成する細胞を作り出すことが可能になるため、再生医療における細胞の供給源として有望である。
(注3)アルギン酸ゲル
海藻などに含まれる食物繊維のアルギン酸を、カルシウムを含んだ水溶液と反応させることによりゲル状に凝固させたもので、常温で瞬間的にゲル化する。ゲルは硬さと透過性をともに有する。
(注4)再生医療
ケガや病気で組織や特定の細胞の機能を失った患者に対し、その治療のため、失った細胞や組織を移植することでその機能を回復させる医療行為。ヒトiPS細胞作製技術の開発により、自分自身の組織を体外で作製し移植する技術の開発に、期待が高まっている。
(注5)細胞外基質
生物において、細胞の外に存在する超分子構造体であり、細胞の振る舞いを変化させることができる動的かつ機能的な物質で、細胞外マトリックスとも呼ばれる。ヒトiPS細胞の二次元培養においても、細胞外基質によるシャーレのコーティングが必須である。代表例としてコラーゲン、ラミニン(マトリゲルの主成分)、ヒアルロン酸などが挙げられる。
(注6)分化
ある細胞がより特殊な機能を持った細胞に変化すること。一例として、造血幹細胞が、白血球、赤血球、血小板などに分化することが挙げられる。分化する前の細胞の状態を未分化とよぶ。
(注7)マイクロ流体デバイス
微細加工技術を利用して作製された、微小流路や反応容器の総称。近年、バイオ研究や化学工学分野等への応用が盛んに行われている。
(注8)三胚葉
内胚葉、中胚葉、外胚葉のこと。体を構成する細胞は基本的にいずれかの胚葉に由来するため、分化多能性を示すためには、各胚葉で特異的な組織や、遺伝子、タンパク質の発現を調べる。