会見日時:平成28年6月9日(木)14:00~15:00
会見場所:東京大学生産技術研究所 大会議室(An301・302号室)
発表者
竹内 昌治
(東京大学生産技術研究所 教授、公益財団法人神奈川科学技術アカデミー人工細胞膜システムグループ グループリーダー 兼任)
神谷 厚輝
(公益財団法人神奈川科学技術アカデミー人工細胞膜システムグループ 研究員、JSTさきがけ「細胞機能の構成的な理解と制御」研究員 兼任)
発表のポイント
◆リン脂質組成非対称平面膜 (注1) にジェット水流を加えることにより、物理法則に従い残留オイルの少ないリン脂質組成非対称膜リポソーム (注2) の作製に成功した。
◆細胞膜の組成を模倣したリン脂質組成非対称膜リポソームにより、リン脂質分子運動(フリップ-フロップ、注3) やペプチド・膜タンパク質とリン脂質分子の相互作用観察に成功した。
◆今回作製に成功したリン脂質組成非対称膜リポソームは、細胞膜を忠実に模倣したリン脂質組成非対称膜リポソーム上で生体分子の活性・機能評価を観察することにより、ペプチドやタンパク質の未知機能や活性条件の発見が期待されます。基礎研究分野のみならず、薬物キャリア等へのドラッグデリバリーシステムへの応用や人工細胞モデル作製の基盤技術としても期待されます。
発表概要
東京大学生産技術研究所の竹内 昌治(たけうち しょうじ) 教授と神奈川科学技術アカデミーの神谷 厚輝(かみや こうき)研究員らの研究グループは、MEMS技術(注4)を利用して、有機溶媒層が存在しない細胞膜の組成を模倣したリン脂質組成非対称膜リポソームの作製に成功しました。リン脂質組成非対称膜リポソームを用い、脂質二重膜の内膜-外膜間のリン脂質の反転運動(フリップ-フロップ)やペプチドとの相互作用観察に成功しました。さらに、膜タンパク質(注5)コネキシン(注6)の取込みがリン脂質非対称組成リポソームであると増大することが、このリン脂質組成非対称膜リポソームを用いた実験により明らかになりました。
通常、マイクロ流体デバイス(注7)を用いたリポソーム作製ではリポソーム膜内に有機溶媒層が存在し、この有機溶媒層がリポソームの安定性やリン脂質の運動性に大きく影響を与えます。本研究グループは、リン脂質平面膜にジェット水流を加えることによってリン脂質マイクロチューブを形成し、このリン脂質マイクロチューブが分裂することにより、有機溶媒層が存在しないリポソームを作製することに成功しました。リン脂質マイクロチューブの不均一な変形によって有機溶媒の不均一な局在が生じ、有機溶媒層が存在しないリポソームが得られたものと考えられます。また、リン脂質平面膜の面積やジェット水流を加える時間等を制御することにより、細胞サイズのリポソームを作製することが可能になりました。
加えて、このリン脂質組成非対称膜リポソーム上のリン脂質の分子運動(フリップ-フロップ)が実際の細胞のアポトーシス(注8)時に起きるフリップ-フロップと同程度のタイムスケールで生じることがわかりました。また、膜と相互作用するペプチドをリン脂質非対称組成リポソームに添加したところ、リン脂質のフリップ-プロップが通常の10倍促進されました。さらに、外膜に負電荷のリン脂質が存在する非対称膜組成では、膜タンパク質の取込みが増大することが明らかになりました。この結果は、生体膜がリン脂質組成非対称膜である意義の1つを示唆する結果であると考えます。このリン脂質組成非対称膜リポソームを用いることで、ペプチドやタンパク質の未知機能や活性条件の発見や、今後の人工細胞モデル構築研究における基盤技術として貢献することが期待されます。この研究は、東京大学、公益財団法人神奈川科学技術アカデミー、京都大学と共同で行いました。
本成果は、学術誌「Nature Chemistry」にて公開されます。
発表内容
【研究の背景と経緯】
細胞膜は細胞内外を隔てるだけではなく、生命活動に不可欠な反応場になっています。特に、真核細胞の膜構造は、内膜と外膜が異なるリン脂質種で構成される脂質2重膜(リン脂質非対称膜)であり、さまざまな生物学的反応に影響を及ぼすことが知られています。
細胞膜の主成分であるリン脂質から構成されるリポソームを用いて、現在、細胞機能の一部を模倣した人工細胞モデル構築研究が盛んに行われています。このような研究で用いられているリポソームの多くは、静置水和法やエレクトロフォーメーション法(注9)と呼ばれる古典的な作製法で作製されてきました。これらの作製法は、リン脂質の薄膜から自己組織的にリポソームを形成させる方法であるため、原理上リン脂質非対称膜の形成は不可能です。
近年、マイクロ流体デバイスを利用したリポソーム作製法が多数報告されています。これらの方法では、単一サイズのリポソームやリン脂質非対称膜リポソームが形成可能ですが、リポソーム形成時に使用する有機溶媒(n-デカン等)がリポソーム膜内に多く残留し、この残留有機溶媒がリポソームの安定性やリン脂質分子の運動性に影響を与えます。そこで、残留有機溶媒が少なく、なおかつ細胞膜環境を模倣したリン脂質組成非対称膜リポソームの作製が求められています。
【研究の内容】
本研究グループは、マイクロデバイスを用いて(図1)、液滴接触法で形成される平面リン脂質二重膜の形成面積とジェット水流を加える時間を制御することにより、平面リン脂質2重膜にジェット水流を加えるとリン脂質マイクロチューブが形成され、大きなリポソーム(直径約150-200 μm)と小さな細胞サイズのリポソーム(直径約5-20 um)に分裂することを高速度カメラにより確認しました(図2,3)。このリン脂質チューブの不均一な分裂の様子を数値流体力学シミュレーションにより解析したところ、レイリー・プラトー不安定性(注10)という物理法則がこのリポソーム形成に支配的に関わっていることが示唆されました。細胞サイズのリポソームをピペット操作で回収し、リポソーム内に含まれる残留有機溶媒(n-デカン)量をラマン分光法(注11)により分析しました。その結果、本方法で作製したリポソームに混入している有機溶媒の量は、有機溶媒層が形成されないほど少量であることが明らかになりました。次に、本方法で作製したリン脂質組成非対称リポソームを用い、脂質のホスファチジルセリンの分子運動(フリップ-フロップ) の観察を行ったところ、約10時間で完全にリン脂質が混和されました(図4)。この混和時間は細胞のアポトーシス時のホスファチジルセリン分子の混和時間と同程度でした。有機溶媒層が存在するリン脂質組成非対称膜リポソームでは、ホスファチジルセリンのフリップ-フロップ運動は見られませんでした。この実験結果により、本研究グループが作製したリン脂質組成非対称膜リポソームはリン脂質の分子運動が観察可能な点において優位性が示されました。
また、ホスファチジルエタノールアミン(PE)と特異的に結合するペプチドであるシンナマイシンを、外膜:ホスファチジルコリン(PC)、 内膜: ホスファチジルコリン(PC)/ホスファチジルセリン(PS)/ホスファチジルエタノールアミン(PE)で構成されるリン脂質組成非対称膜リポソームに作用させたところ、シンナマイシンがリン脂質組成非対称膜リポソームのホスファチジルエタノールアミンと結合したことを確認しました。さらに、内膜に存在しているホスファチジルセリンの外膜への移動が通常よりも促進されることも明らかにしました(図5)。
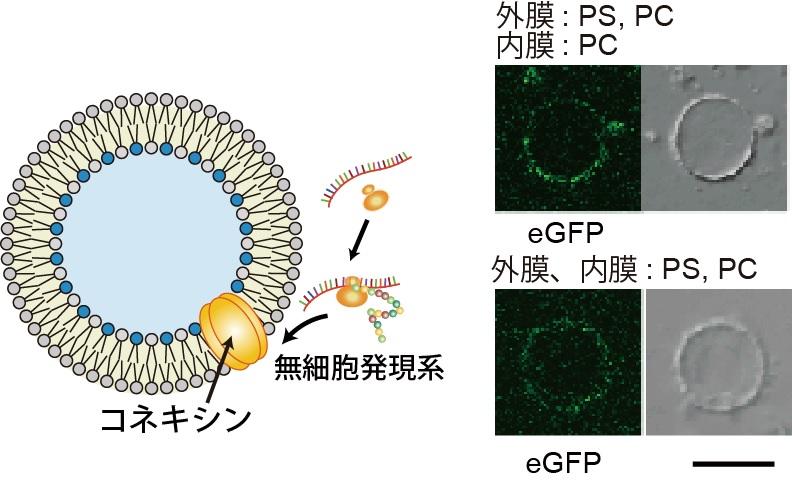
さらに、本研究グループは、このリン脂質組成非対称膜リポソーム溶液内で、無細胞タンパク質合成系(注12)で発現させた膜タンパク質コネキシンのリポソーム膜への取込み量変化についての実験も行いました。実験の結果、外膜にモル濃度で50 %以上の負電荷のリン脂質(ホスファチジルセリン(PS))が存在するリン脂質組成非対称膜において、コネキシンのリン脂質膜への取込みが向上することが分かりました(図6)。また、コネキシンタンパク質がナノポアを形成することを利用して、コネキシンのナノポアを介したリポソームの内水層から外水層への蛍光色素の輸送観察に成功しました。また、コネキシンのリン脂質膜への再構成量に依存し、リポソーム内の蛍光量が低下することも確認しました。さらに、電気生理学的測定(注13)により、コネキシンのナノポア1分子を通過するイオンの流れを測定しました。ここで得られた結果は、培養細胞で発現させたコネキシンナノポアと似た結果であることから、無細胞タンパク質合成系で発現されたコネキシンが正しいコンフォメーションでリポソーム膜に再構成されていることが示唆されました。これらの結果は、真核生物の生体膜組成が非対称である意義の1つを示していると考えています。
【今後の展開】
本研究グループは、ジェット水流やリン脂質平面膜面積を調節することで、レイリー・プラトー不安定性により有機溶媒の残留が少ないリン脂質組成非対称膜リポソーム作製に成功しました。このような残留有機溶媒の影響が少ないリン脂質組成非対称膜リポソームにより、リポソームの安定性向上やリン脂質の分子運動の観察が可能になりました。さらに、このリン脂質組成非対称膜リポソームを用いて、非対称膜組成により膜タンパク質コネキシンの取込み量が増大することを発見しました。今後はこのリン脂質組成非対称膜リポソームを用い、生体膜がリン脂質組成非対称である意義を解き明かしていく予定です。
現在、ペプチドやタンパク質等の生体分子の活性・機能評価には、実際の細胞膜組成とかけ離れたリン脂質対称膜のリポソームが使用されています。今後は、細胞膜を忠実に模倣したリン脂質組成非対称膜リポソーム上で生体分子の活性・機能評価を観察することにより、ペプチドやタンパク質の未知機能や活性条件の発見が期待されます。このリン脂質組成非対称膜リポソームは基礎研究分野のみならず、薬物キャリア等へのドラッグデリバリーシステムへの応用も期待されます。
発表雑誌
雑誌名:Nature Chemistry論文タイトル:Cell-sized asymmetric lipid vesicles facilitate the investigation of asymmetric membrane
著者: Koki Kamiya, Ryuji Kawano, Toshihisa Osaki, Kazunari Akiyoshi and Shoji Takeuchi
DOI番号:10.1038/NCHEM.2537
論文URL:http://www.nature.com/nchem/journal/vaop/ncurrent/full/nchem.2537.html
問い合わせ先
<研究に関すること>東京大学生産技術研究所
教授 竹内 昌治(たけうち しょうじ)
〒153-8505 東京都目黒区駒場4-6-1
Tel:03-5452-6650 Fax:03-5452-6649
研究室URL:http://www.hybrid.iis.u-tokyo.ac.jp/
<神奈川科学技術アカデミーに関すること>
公益財団法人 神奈川科学技術アカデミーイノベーションセンター
地域イノベーション推進グループ
水野 雄介(みずの ゆうすけ)
〒213-0012 神奈川県川崎市高津区坂戸3-2-1 KSP西棟6階614
Tel:044-819-2031 Fax:044-819-2026
HPアドレス:http://www.newkast.or.jp/
用語解説
(注1) リン脂質組成非対称膜脂質二重膜の外膜と内膜で異なったリン脂質分子の構成を言う。例えば、真核細胞の形質膜は、主に、外膜にはホスファチジルコリンやスフィンゴミエリンが多く存在し、内膜にはホスファチジルコリンやホスファチジルエタノールアミンが多く存在している。
(注2) リポソーム
リン脂質二重膜から構成され内部に水相をもつ閉鎖小胞。リポソームは生体膜の脂質二重膜部分の動態を検討するうえで有効なモデル系ある。また、膜タンパク質を再構成することや、内水相や脂質二重膜に種々の物質を保持できることからバイオリアクタやマイクロカプセルとして応用が盛んである。特に、細胞サイズリポソーム(直径1 um以上)は、光学顕微鏡で容易に観察できるため、人工細胞モデル研究で盛んに用いられている。
(注3) フリップ-フロップ
リン脂質二重膜の外膜-内膜間のリン脂質の反転運動。
(注4) MEMS技術
各種の微細加工技術を応用し、微小な電気要素と機械要素を組み合わせたデバイスやシステムを構築する技術。MEMSとは、Micro Electro Mechanical Systemsの頭文字をとったもの。
(注5) 膜タンパク質
細胞膜に存在するタンパク質の総称。特に、細胞膜を貫通しているものを膜貫通タンパク質とよぶ。Gタンパク質共役受容体やイオンチャネルが膜貫通タンパク質にあたる。
(注6) コネキシン
4回膜貫通タンパク質で6量体のナノポアを形成。6量体を形成したナノポア同士が結合(ギャップ結合)し直接細胞質内に低分子物質を送り込む。
(注7) マイクロ流体デバイス
MEMS技術などの微細加工技術を利用して作製された、微小流路や反応容器の総称。近年、バイオ研究や化学工学分野等への応用が盛んに行われている。
(注8) アポトーシス
生理条件下で細胞が自ら積極的に引き起こす細胞死。アポトーシスを誘発した細胞にホスファチジルセリンの細胞表面への露出が観察される。
(注9) 静置水和法、エレクトロフォーメーション法
細胞サイズリポソームの古典的作製法。アルゴン気流下でクロロホルムに溶解したリン脂質を、ガラス板上で乾燥させリン脂質フィルムを形成させる。リン脂質フィルムに緩衝溶液等を加え静置(静置水和法)や交流電場を加えること(エレクトロフォーメーション法)により、自己組織的にリポソームを形成させる。
(注10) レイリー・プラトー不安定性
円筒形の水流が液滴に変化する理論。液体の円柱は、その外周よりも大きな波長をもつ変形が生じると自発的に変形し表面エネルギーを減らす。そして、変形が増幅され、液体の円柱は最終的に液滴に分裂する。この理論はさまざまな産業分野で応用されている。例えば、インクジェットプリンタのインク噴出も該当する。
(注11) ラマン分光法
物質の分子構造や結晶構造などを知る解析手法の一つ。光が物質に入射して分子と衝突すると、その一部は散乱される。散乱光の大部分は入射光と同じ波長(レイリー散乱光)であるが、入射光と異なった波長の光(ラマン散乱光)もごくわずかに含まれる。ラマン分光法では、このラマン散乱光を分析することで、分子レベルの構造を解析する。
(注12) 無細胞タンパク質合成系
生体の遺伝情報発現系を人工容器に取りそろえ、タンパク質を試験管内で合成する方法。大腸菌、ウサギ網状赤血球、カイコ培養細胞等の抽出液を用いる無細胞系が一般的である。細胞毒性タンパク質の合成、非天然型アミノ酸の導入が可能という利点がある。
(注13) 電気生理学的測定
電気生理学的測定法の1つにパッチクランプ法がある。一般的なパッチクランプ法はガラス製のピペットを細胞表面に当て吸引し、電気的絶縁性を高めると、ピペット内に捕捉された細胞膜に含まれるイオンチャネルを通過するイオンを電流値で測定する。
資料
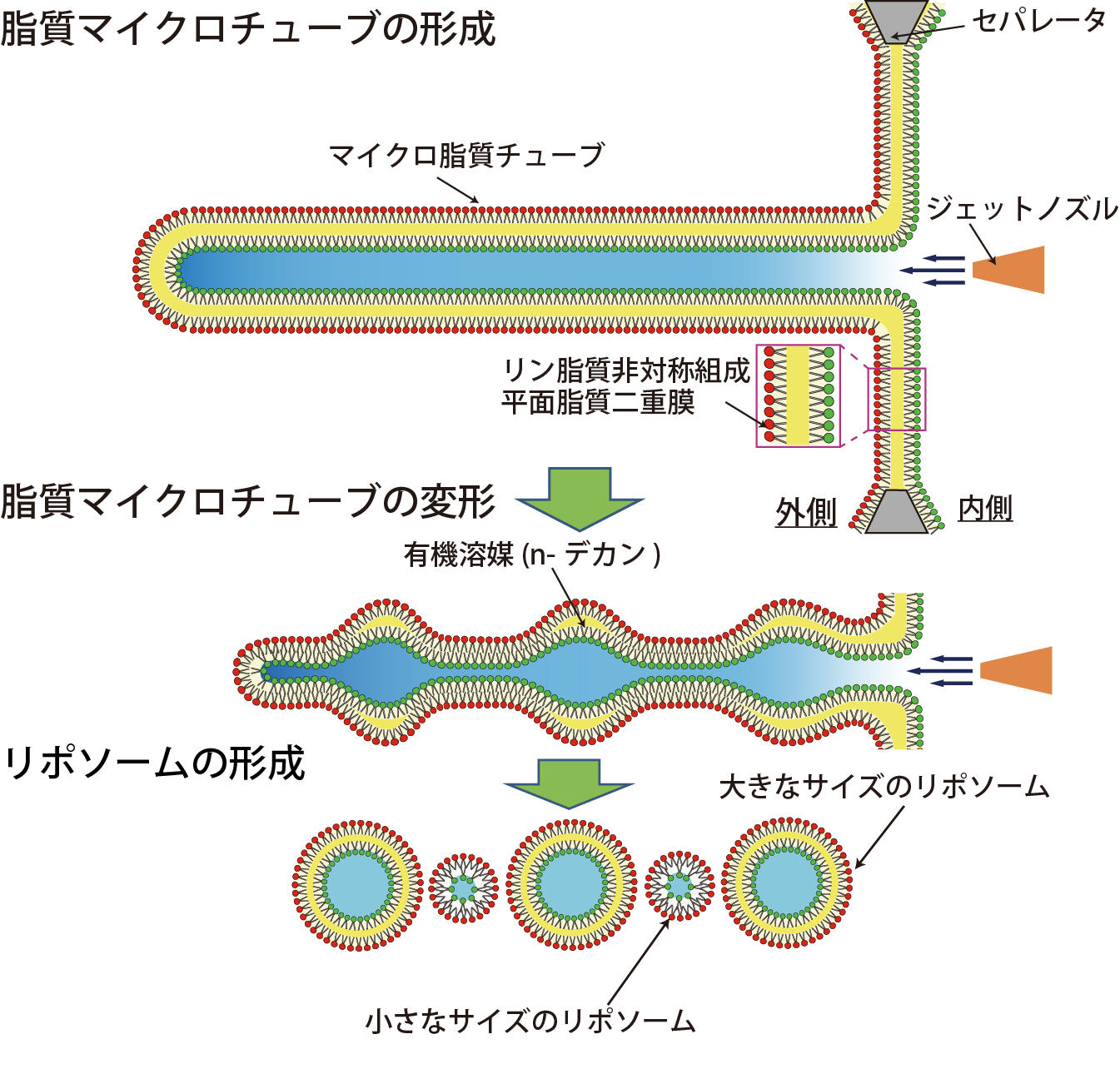
図1. リン脂質組成非対称膜リポソーム作製デバイス。
「8」の字型のダブルウェルの間に薄いアクリルフィルムが配置されており、ウェル間でリン脂質が混和しないようになっています(セパレータ)。セパレータに約200 μm の孔があいており、その孔に平面リン脂質二重膜が形成されます。
図2. 有機溶媒層が存在しないリポソーム形成の模式図。
直径約100から500 μmのマイクロ孔に、接触法によりリン脂質非対称組成平面脂質二重膜が形成されます。ジェット水流を加えると、マイクロサイズのリン脂質チューブが形成されます。脂質マイクロチューブが変形することにより、曲率の高い部位に残留有機溶媒が多く局在すると考えられます。そして、マイクロチューブの分裂により、有機溶媒層が存在しない細胞サイズのリポソームを得ました。
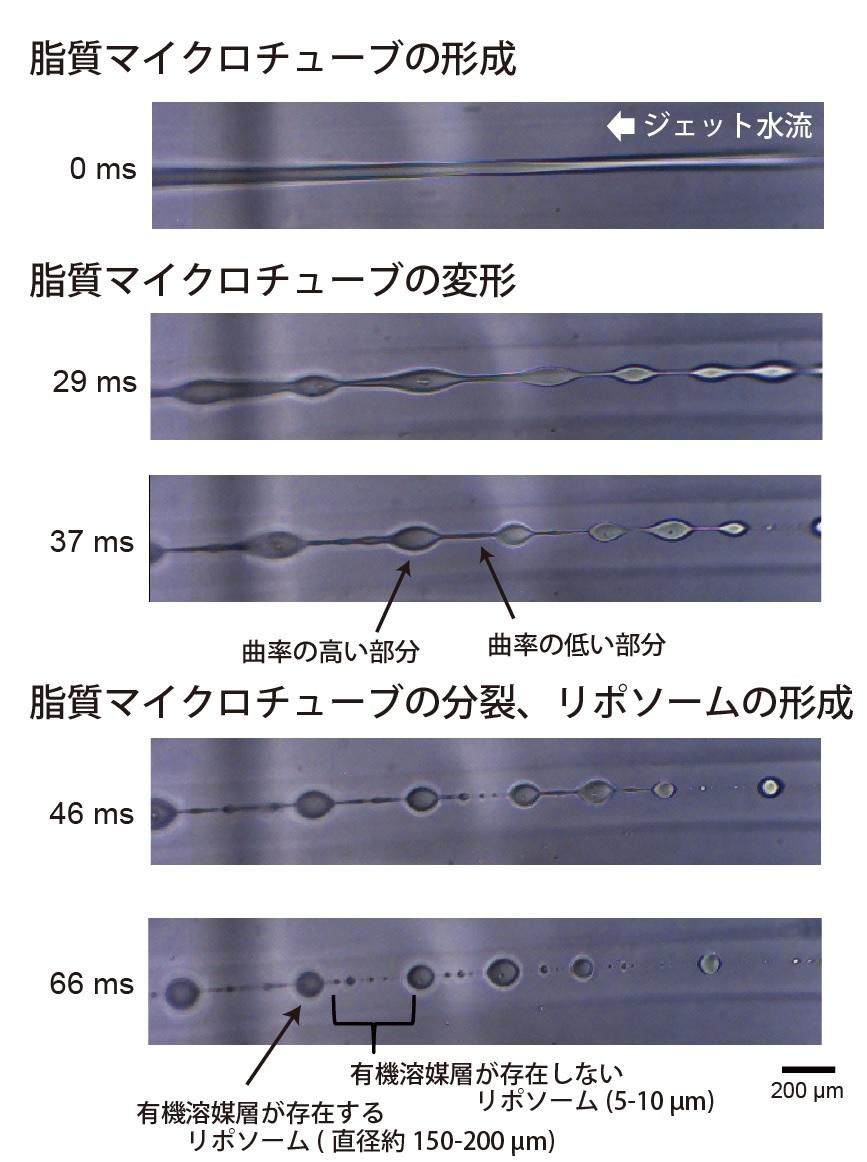
図3. 本リポソーム作製法の高速度カメラ撮影。
ジェット水流を加えた後、脂質マイクロチューブの形成が観察されました。そして、この脂質マイクロチューブが徐々に変形し、曲率の高い部位と低い部分が形成されました。曲率の低い部分が分裂し、細胞サイズのリポソームが形成されました。
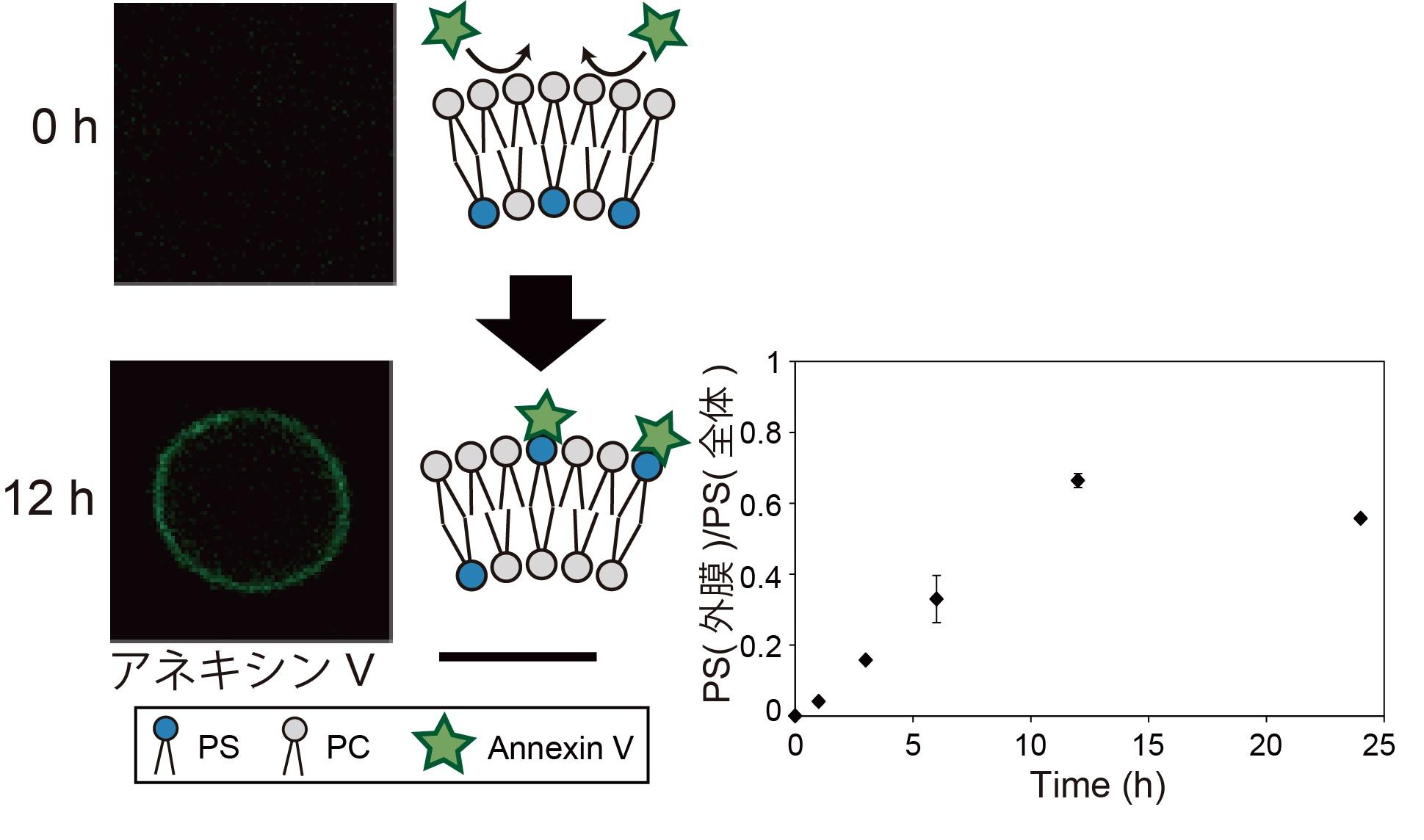
図4. リン脂質組成非対称膜リポソームによる、リン脂質のフリップ-フロップ観察。
内膜にPS 分子が存在するため、リポソーム形成直後にはアネキシンVの蛍光は観察されませんでした。37 度で12 時間放置後、アネキシンVの蛍光がリポソーム膜上に観察されたことから、PS 分子が外膜へ移動したことが分かりました。スケールバー: 10 μm
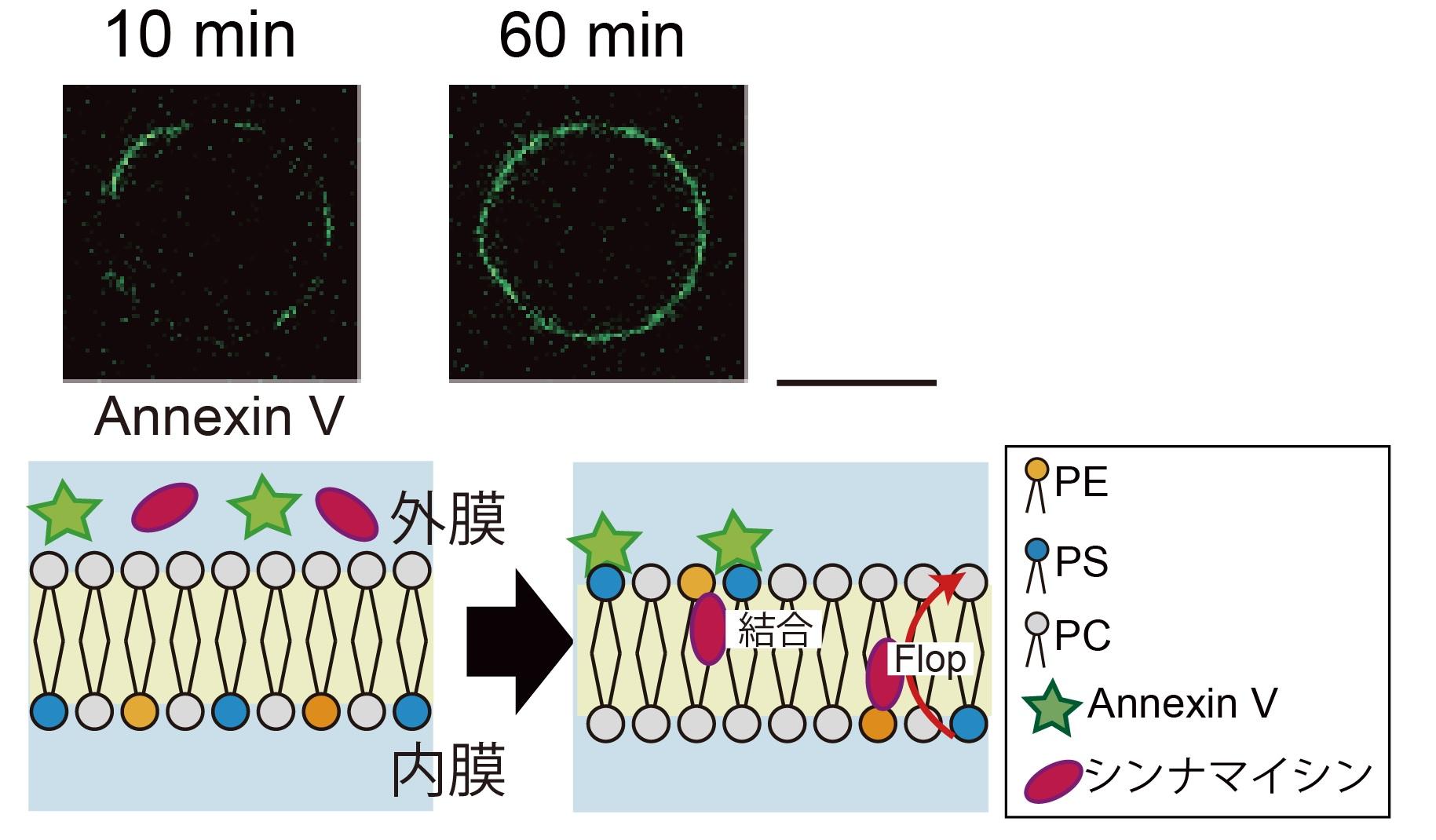
図5. ペプチドとリン脂質非対称膜との相互作用観察。
細胞膜と相互作用するペプチド(シンナマイシン) をリン脂質非対称膜リポソームに添加してリン脂質のフリップ-フロップを観察しました。PE が存在する非対称膜リポソームは、通常よりフロップ速度が速くなりました。スケールバー: 10 μm
図6. リン脂質非対称膜リポソームへの膜タンパク質の取込み。
無細胞タンパク質発現系によりコネキシンをリポソーム外から発現させました。コネキシンは4 回膜貫通タンパク質で、6 量体を形成しナノポアを形成しました。スケールバー: 10 μm