○発表概要
大きな構造を持つアミノ酸は、画像診断薬や特定の細胞と強く相互作用するため、医薬分野で注目されています。しかし従来は、立体的に大きな反応部位にアミノ基を導入すること(アミノ化)が極端に難しく、利用できるアミノ酸の種類は限られていました。
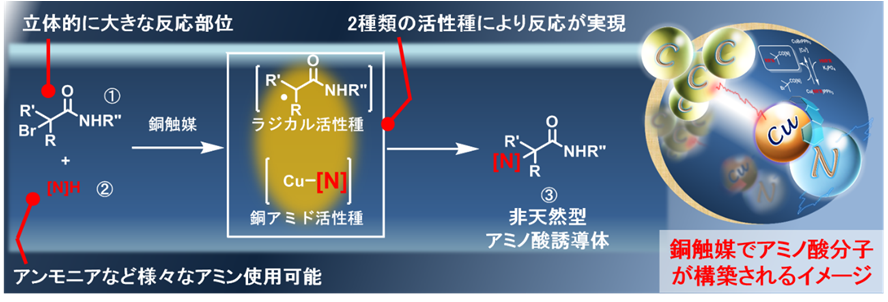
山口大学 大学院創成科学研究科 応用化学分野の西形 孝司 准教授と東京大学 生産技術研究所 物質・環境系部門の砂田 祐輔 准教授らのグループは、銅触媒によってα-ブロモアミド化合物とアミンとのアミノ化反応に成功しました。この原理を利用すると、立体的に非常に大きな反応部位にアミノ基を導入でき、さまざまな非天然型アミノ酸誘導体を作ることができます。天然のアミノ酸はその種類や構造に制限がある一方で、非天然型アミノ酸の種類や構造には制限はなく、期待される機能も無限に付与することが理論上は可能です。医薬分野を始め、広い分野での応用が期待されます。
この研究成果は『Angewandte Chemie, International Edition』(IF=11.994)に掲載されました。
○発表内容
<研究の背景>
生命は20種類の天然アミノ酸を利用することでその活動を維持しています。天然のアミノ酸はその種類や構造に制限がある一方で、天然では得られない非天然型アミノ酸の種類や構造には制限はなく、期待される機能も無限に付与することが理論上は可能です。特に、非常に大きな構造を持つアミノ酸は、画像診断薬や特定の細胞と強く相互作用することが知られており重要な化合物ですが、構造の大きな第4級炭素(注1)中心を持つ構造になると、カルボニル(-COR)の隣接炭素上にアミノ基を導入することは立体的な制限から極端に難しく、合成手法が限られていました(図1)。このため、医薬分野で活用できる非天然型アミノ酸の種類は十分でなく、新しい合成手法の開発が喫緊の課題でした。
<研究の内容>
窒素上を脂肪族炭素(注2)で置換するアミノ化反応自体は、有機化学の教科書にもある、古くから知られている反応です。しかしながら、今回のように立体的に大きな脂肪族炭素になると反応をうまく行うことができませんでした。そこで、山口大学大学院創成科学研究科応用化学分野の西形孝司准教授と東京大学 生産技術研究所 物質・環境系部門の砂田祐輔 准教授らのグループは、銅触媒(注3,注4)によってα-ブロモアミド化合物(注5)とアミンとのアミノ化反応技術を開発しました。このアミノ化反応は、銅触媒を用いてα-ブロモアミド化合物①の臭素(Br)とアミン②を交換することで進行します(図2)。この際に重要となるのがラジカル(注6)と銅アミドと呼ばれる活性種です。銅アミド活性種は銅触媒とアミン②との反応から作られる化学種であり、これがα-ブロモカルボニル化合物(注5)と銅触媒との反応から生じたラジカル活性種と反応することでアミノ化反応が進行します。この原理を利用すると、立体的に非常に大きな反応部位で、アミノ化を行うことができます。また、用いることができるアミン②は、アンモニアやさまざまなアミンを使用することが可能であり、さまざまな非天然型アミノ酸誘導体を作ることができます。
<今後の展開>
今回開発した反応は、非天然型アミノ酸を自在に合成する第一歩となる結果です。今後は、光学活性(注7)な非天然型アミノ酸も合成できるように、反応系をさらに工夫していきます。
本研究は、JSPS科研費挑戦的萌芽研究(16K13995)、JSPS科研費基盤研究B(16H04120)および宇部興産学術振興財団の助成を受けて実施したものです。
○発表雑誌
雑誌名:Angewandte Chemie, International Edition
論文タイトル:Copper-Catalyzed Amination of Congested and Functionalized α-Bromocarboxamides with either Amines or Ammonia at Room Temperature
著者:Syo Ishida, Kentaro Takeuchi, Nobuhiro Taniyama, Yusuke Sunada, and Takashi Nishikata.
DOI番号:10.1002/anie.201706293
○問い合わせ先
<研究に関すること>
山口大学 大学院創成科学研究科 応用化学分野
准教授 西形 孝司
〒755-8611 山口県宇部市常盤台2-16-1
Tel: 0836-85-9261 Fax: 0836-85-9201
資料
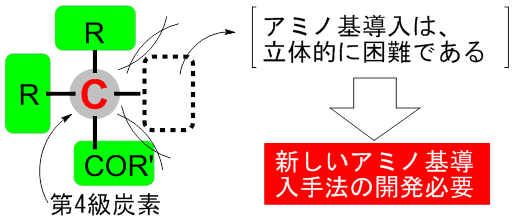
図1 アミノ基導入の困難さ
図2 開発したアミノ化反応
用語解説
(注1)第4級炭素
炭素原子は、その周りに4つまで置換基を配置することができる。炭素原子上が水素原子以外の4つの原子で置換された化合物を第4級炭素と呼ぶ。級数が上がるにつれて炭素原子周りが立体的に混みあってくるため、一般に、4つ目の置換基導入は困難になる。
(注2)脂肪族炭素
炭素と水素から成る化合物を脂肪族といい、直鎖や環状のものが存在する。この化合物は、炭素原子間の結合様式によりさらに分類されている。例えば、炭素-炭素結合が単結合ではアルキル基、二重結合ではアルケニル基、そして三重結合のものはアルキニル基という。
(注3)銅
原子番号29の遷移金属元素であり、硬貨にも使われている身近な元素。Cuと表記される。1、2、そして3価の酸化数をとり、電子状態によって金属中の電子移動の方向が決まる。今回は1価銅を反応に使うことで、銅から1個の電子をα-ブロモカルボニル化合物に移動させて反応を開始している。
(注4)触媒
触媒それ自身は反応の前後で変化しないが、反応の最中に物質にさまざまな反応性を付与する機能を持つ。触媒を用いると、反応に必要なエネルギーを著しく低下できることから、近年では省エネルギーの反応プロセスの確立に欠かせない方法論である。触媒は、酸(H+)のような単純なものや、金属、そして、複雑な有機分子など多岐にわたる。
(注5)α-ブロモアミド化合物/α-ブロモカルボニル化合物
非常に大きな炭素官能基を持つ臭素化物であり、α-ブロモカルボニル化合物群に属する化学物質。この物質の特徴は2つあり、1つは、銅触媒を反応させると炭素ラジカル種という反応性の高い化学種を生成することが可能で、反応性の高い化学種はさまざまな分子合成に不可欠である。もう1つの特徴は、カルボニル基という官能基を持つため、反応後に官能基を他の官能基に変えることが容易で、これにより、望みの機能を分子に付与することが可能である。
(注6)ラジカル
物質にはプラス、マイナス、そして中性の状態がある。それぞれの状態によってどのような有機反応が進行するのかが決まってくる。その中でもラジカルは中性物質に属するが、エネルギーの非常に高い状態を維持しており、あらゆる物質への反応性を示すため、その制御は難しい。近年では、光やある種の元素を用いたラジカルの制御法が開発されてきており、重要な最先端研究課題の対象である。身近なラジカル反応としては、食品などの酸化やオゾン層の破壊がある。
(注7)光学活性
有機分子には、形が同じでも原子配置が異なるため重ね合わせることができない構造が存在する。両者は、ちょうど鏡に映したような関係になる。このような化合物を光学活性という。身近な分子ではアミノ酸が光学活性である。